Critical Reviews in Biotechnology, 22(3):245-279 (2002)
Botryococcus braunii: Een vernieuwbare bron van waterstoffen en andere chemicaliën
Anirban Banerjee,1 Rohit Sharma,1 Yusuf Chisti,2 en U. C. Banerjee1*
1Department of Biotechnology, National Institute of Pharmaceutical Education and Research, Sector 67, S.A.S. Nagar (Mohali) 160062, Punjab, India; 2Institute of Technology and Engineering, Massey University, Private Bag 11 222 Palmerston North, Nieuw-Zeeland* Corresponderende auteur: Telefoon: +91-172-214682, Fax: +91-172-214692, E-mail adres: ucbanerjee@niper.ac.in
Inhoudsopgave
Samenvatting: Botryococcus braunii, een groene koloniale microalg, is een buitengewoon rijke vernieuwbare bron van koolwaterstoffen en andere chemicaliën. Koolwaterstoffen kunnen tot 75% van het droog gewicht van B. braunii vormen. Dit onderzoek beschrijft de verschillende facetten van de biotechnologie van B. braunii, met inbegrip van de microbiologie en fysiologie; de productie van koolwaterstoffen en andere verbindingen door de alg, de kweekmethoden; verdere terugwinning en verwerking van algen-koolwaterstoffen; en het klonen van de algengenen in andere micro-organismen. B. braunii converteert eenvoudige anorganische verbindingen en zonlicht om potentiële koolwaterstof brandstoffen en grondstoffen voor de chemische industrie. Micro-organismen zoals B. braunii kunnnen op de lange termijn onze afhankelijkheid van fossiele brandstoffen verminderen en als gevolg hiervan blijft B. braunii veel aandacht trekken.
Trefwoorden: Botryococcus braunii, microalgen, algen-koolwaterstoffen, botryococcene, algenkweek, fotobioreactoren.
© 2002 by CRC Press LLC
I. Inleiding
De eencellige fotosynthetische microalg Botryococcus braunii is lid van de chlorophyceae (chlorophyta). Reeks-analyse van de kleine subeenheid van r-RNA (16s RNA) en de vergelijking met de reeksen voor de andere algen suggereert dat B. braunii nauw verwant is aan Characium vaculatum en Dunaliella parva (Sawayama et al., 1995). Deze koloniale microalg is wijdverbreid in zoete en brakke wateren van alle continenten (Chisti, 1980). Het kosmopolitische karakter van de algen wordt bevestigd door de stammen van oorsprong uit de Verenigde Staten (Wolf et al., 1985a, b), Portugal, Bolivia, Frankrijk, Ivoorkust, Marokko, de Filippijnen, Thailand en de West-Indië (Metzger et al., 1985a). Deze geografische regio's behoren tot verschillende klimaatzones, inclusief de continentale, gematigde, tropische en alpiene zones.
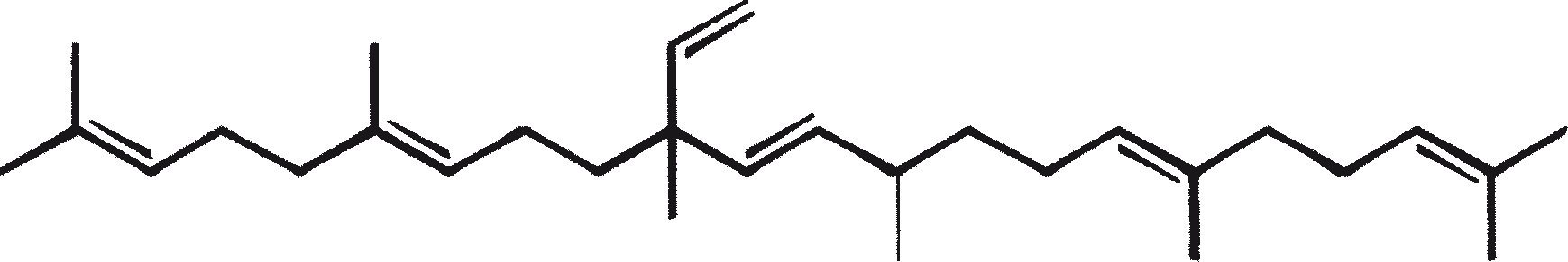
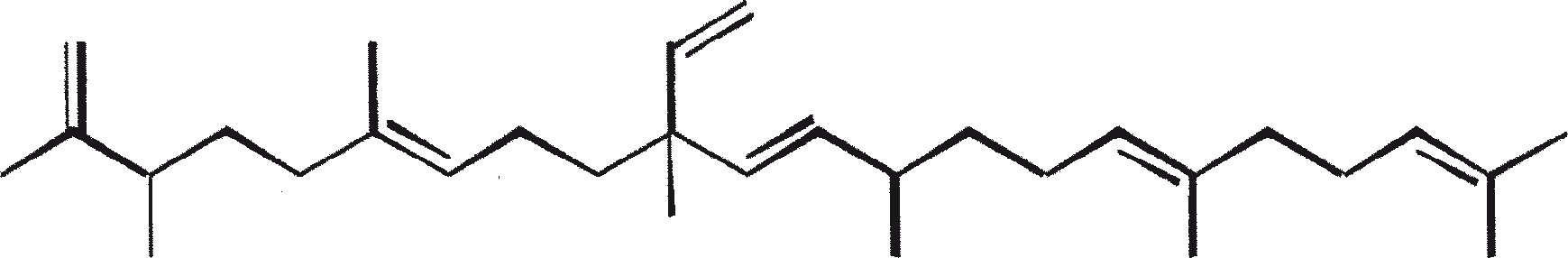
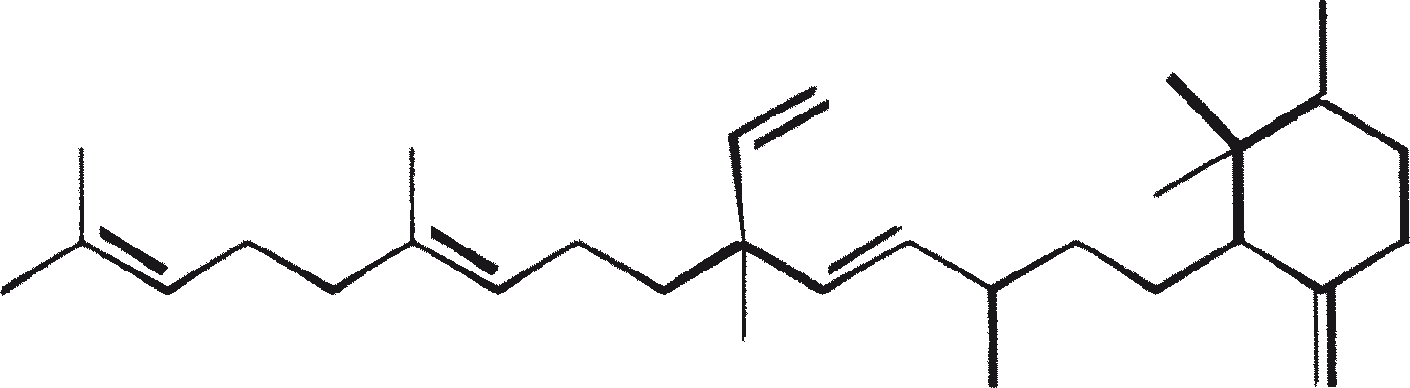
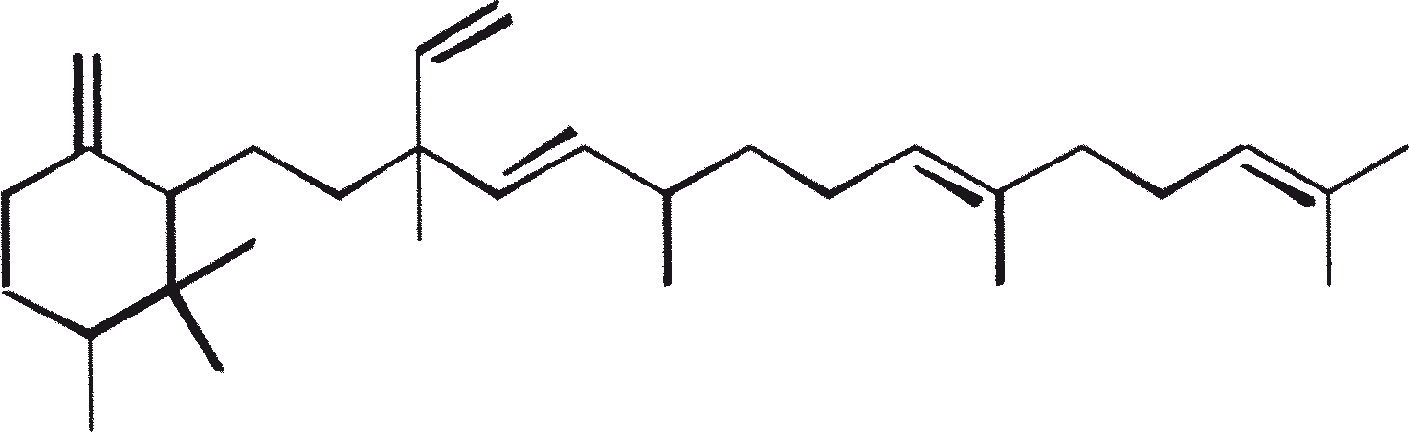
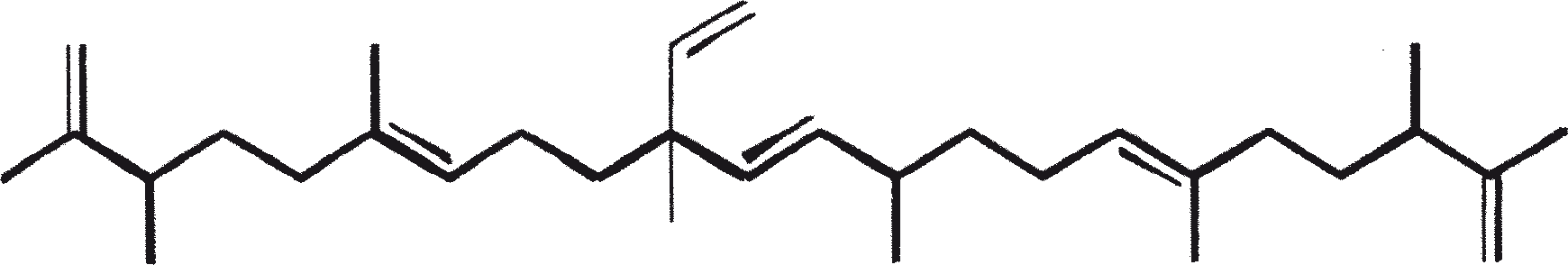
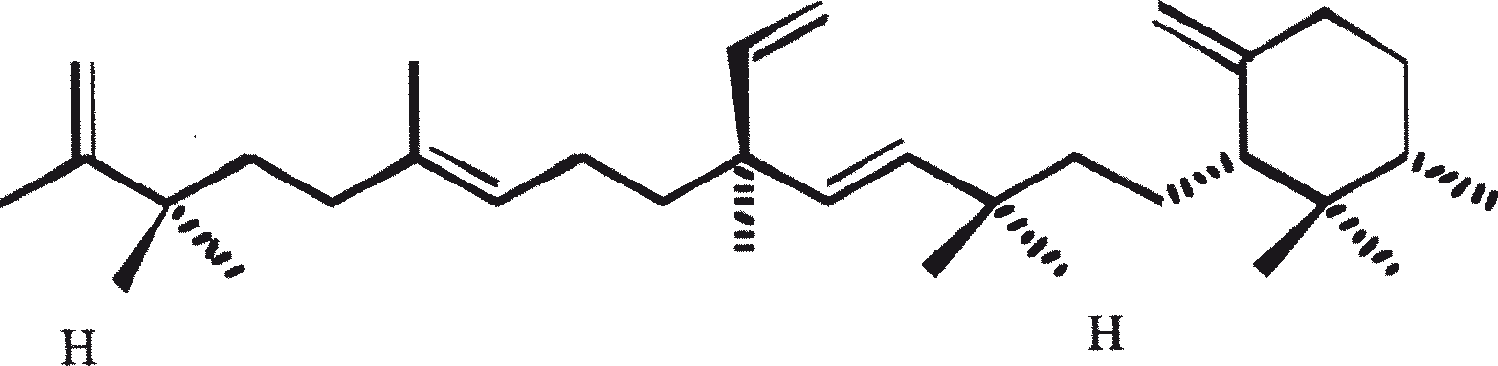
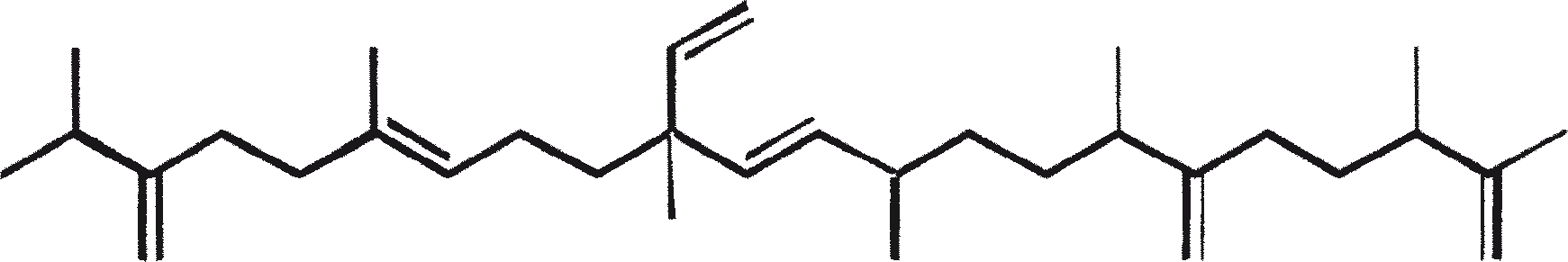
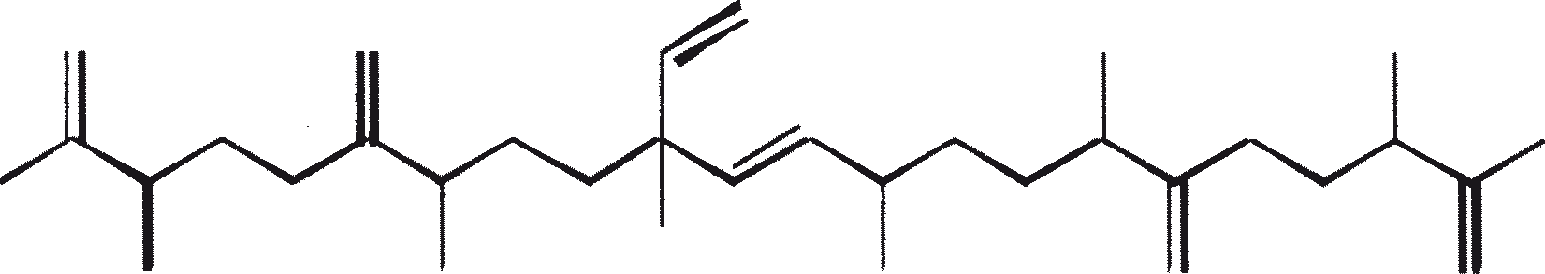
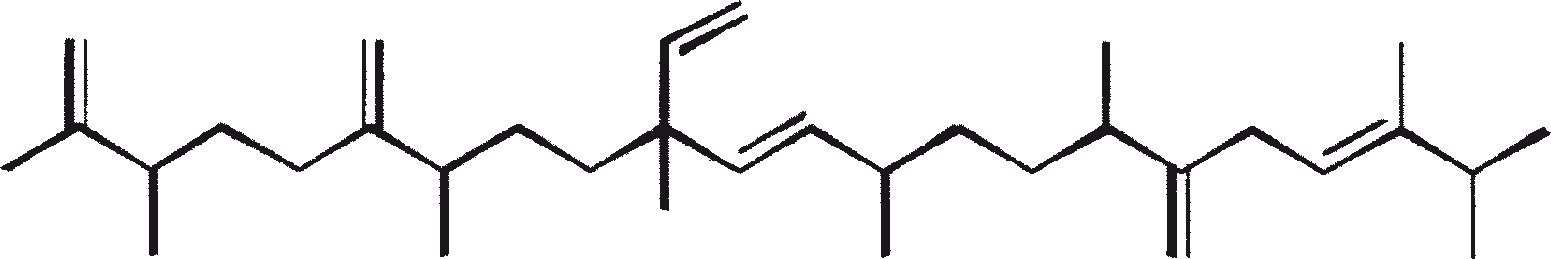
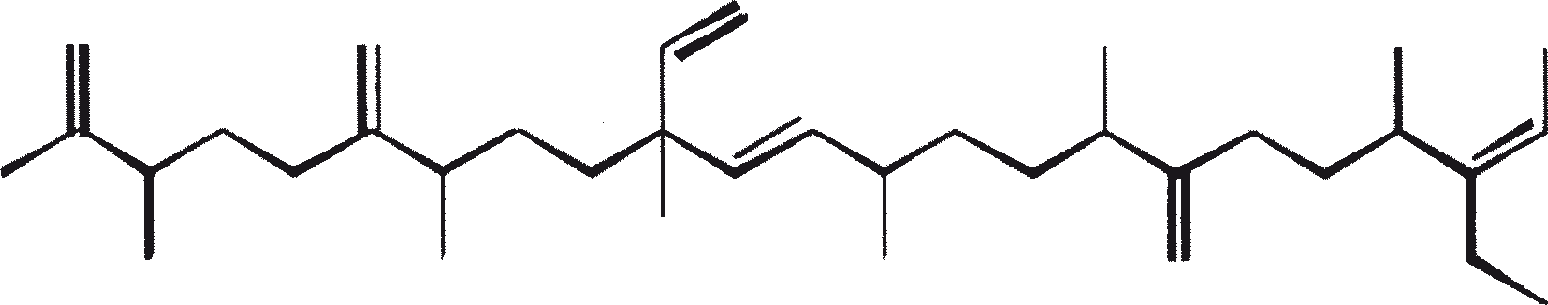
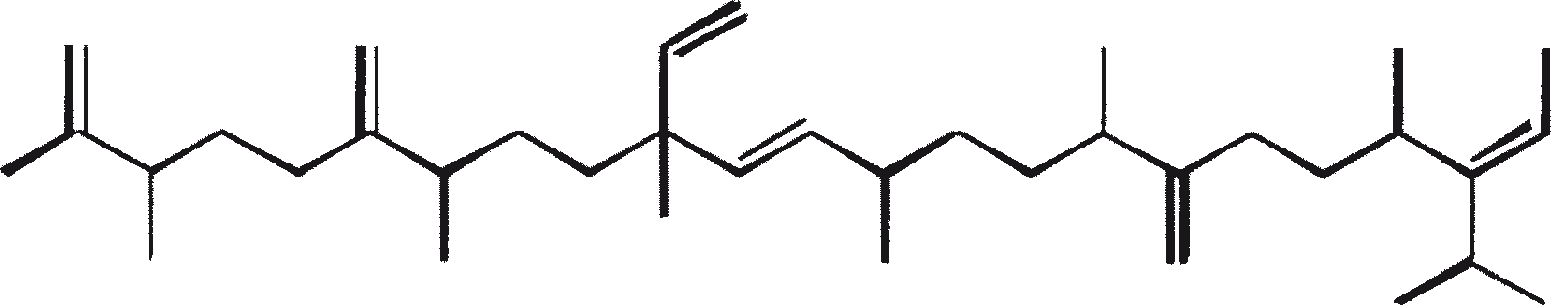
B. braunii wordt beschouwd als een potentiële bron van duurzame brandstof vanwege haar vermogen om grote hoeveelheden koolwaterstoffen produceren. Afhankelijk van de stam en de groeiomstandigheden kunnen tot 75% van de droge massa van de algen koolwaterstoffen zijn. De chemische aard van de koolwaterstoffen is afhankelijk van de producerende stam. Drie rassen van B. braunii zijn gedocumenteerd, en deze kunnen worden onderscheiden op basis van de karakteristieke koolwaterstoffen die zij produceren. Het A-ras produceert oneven genummerde C25 tot C31, n-alkadiënen, en trienes. Het B-ras produceert triterpenoïde koolwaterstoffen, genaamd botryococcenes (CnH2n-10, n = 30-37), blijkbaar van isoprenoïde oorsprong (Chisti, 1980). Het L-ras produceert lycopadiene, een C40 tetraterpeen.
Historisch gezien is de belangstelling voor B. braunii ontstaan als gevolg van de geochemische betekenis. Paleobotanical studies suggereren dat B. braunii is een van de belangrijkste bronnen van koolwaterstoffen in een verscheidenheid van de olie-rijke afzettingen uit de periode van het Ordovicium tot heden (Cane, 1977). Lycopadiene kan de precursor van lycopane zijn, gevonden in sommige lacustriene sedimenten. Het voorkomen van botryococcane, C34H70, de gehydrogeneerde afgeleide van botryococcene, op een niveau van 0,9 en 1,4% is gemeld in twee soorten Sumatraanse ruwe oliën (Moldwan and Seifert, 1980). Deze concentraties zijn op het hoogste niveau ooit gemeld voor een enkele complexe fossiele biologische marker in aardolie (Moldwan and Seifert, 1980). Botryococcane is gevonden in een reeks van kustgebieden met bitumen (kerogeen) formaties in Australië (Mcirdy et al., 1986). B. braunii is de belangrijkste bron van C27, C29, C31 alkanen gevonden in het Pula sediment, een picoleneoliehoudende leisteen, uit Hongarije (Lichitfouse et al., 1994). Onlangs was een C30 botryococcene gerelateerde verbinding, 7, 11-cyclobotryococca 5, 12, 26-triene geïsoleerd in de biologische rijke sedimenten van het meer van Cadagno, Zwitserland, waaruit het wijdverspreide karakter van B. braunii blijkt in recente en verleden omstandigheden (Behrens et al., 2000).
Weinig oliehoudende leisteen bevat botryococcene, hoewel B. braunii op grote schaal voorkwam tijdens de vorming van deze leisteen. Deze schijnbare tegenstelling is te verklaren door de afbraak van botryococcenes door de hoeveelheid zuurstof van de vroege diagenese (Derenne et al., 1988). Spectroscopische studies (FTIR, GC-MS, etc.) op onverwarmde materialen en pyrolyzates geven aan dat een overheersende fractie van coorongite (75% van de vrije fractie bitumen), een rubberachtige afzetting, bestaat uit de degradatie-resistente biopolymeren van de buitenwanden van B. braunii. Deze celwand biopolymeren zijn slechts marginaal beïnvloed door de extreme zuurstof condities van coorongite formatie.
Van B. braunii is gemeld dat 3% van de zonne-energie wordt omgezet in koolwaterstoffen (Gudin et al., 1984). Omdat het een fotosynthetisch organisme is, kan de alg CO2 uit de atmosfeer binden. Bijgevolg is het verbranden van koolwaterstoffen uit algen geen netto toevoeger aan de CO2-concentratie in de atmosfeer. De thermische waarde van biomassa afgeleide koolwaterstoffen varieert tussen de 30.000 en 42.000 kJ/kg (Held et al., 1985). Het omzetten van een 100-MW thermische centrale van het gebruik van kolen naar het gebruik van vloeibare brandstof afkomstig van B. braunii kan de CO2-uitstoot verminderen met 1,5 × 105 ton/jr (Sawayama et al., 1999). Potentieel zouden de CO2-emissie waarden verder worden verminderd door verbetering van de CO2-fixatie efficiëntie van de algen. Een aanzienlijke inspanning wordt besteed aan het bereiken van dit doel.
Dit onderzoek bespreekt de microalg B. braunii; de synthese van koolwaterstoffen en andere biochemicaliën door de alg, de kweek omstandigheden voor de productie van koolwaterstoffen; de verdere terugwinning en verwerking van algen-koolwaterstoffen; het klonen in andere micro-organismen van de B. braunii genen die verantwoordelijk zijn voor koolwaterstof-synthese.
II. Rassen van de B. braunii
B. braunii bestaat in drie verschillende rassen: A, B, and L. De rassen kunnen over het algemeen worden onderscheiden op basis van de karakteristieke koolwaterstoffen die zij produceren. Ras A produceert C25 tot C31, oneven-genummerde n-alkadiënen en alkatrienes. Deze lineaire olefinen kunnen tot 61% van de droge celmassa van de groene-state actieve kolonies vormen (Gelpi et al., 1970). Twee ongewone koolwaterstoffen, C27H51 triene en C27H48 tetraene, werden geïsoleerd uit een B. braunii stam afkomstig uit Lake Overjuyo, Bolivia.
Het B-ras produceert gepolymethyleerde onverzadigde triterpenen, genaamd botryococcenes (CnH2n-10, n = 30-37). Botryococcenes kunnen bestaan als isomeren met hetzelfde aantal koolstofatomen, maar verschillende structuren. In natuurlijke populaties kunnen botryococcene 27 tot 86% van de droge celmassa vormen (Brown and Knights, 1969). Het L-ras produceert een enkele koolwaterstof C40H78, een tetraterpeen, bekend als lycopadiene (Metzger et al., 1990). Dit koolwaterstof is goed voor 2 tot 8% van de droge biomassa (Metzger and Casadevall, 1987).
De drie rassen kunnen worden onderscheiden op basis van bepaalde morfologische en fysiologische kenmerken (tabel 1). De cellen van het L-ras (8 tot 9 µm × 5 µm in omvang) zijn relatief kleiner dan de cellen van rassen A en B (13 µm × 7-9 µm) (Metzger et al., 1988). Het L-ras bevat ook minder pyrenoid (Metzger et al., 1988). Een ander verschil tussen de rassen is de koloniekleur in de stationaire fase. De B- en L-ras algen worden rood-oranje en oranje-bruinachtig vanaf de groene kleur van de actieve toestand. De A-ras alg wordt lichtgeel vanaf groen. Dit verschil is te wijten aan de accumulatie van keto-carotenoïden (canthaxanthine, echinenone, adonixanthin, enz.) in de stationaire fase van de B- en L-rassen.
Onderscheidende kenmerken van de rassen van B. braunii
| B. braunii | |||
| Ras-A | Ras-B | Ras-L | |
| Aard van koolwaterstoffen | C25-C31 oneven genummerde n-alkadiënen/trienes | Botryococcenes (triterpenen) CnH2n-10, n = 30-37 |
Lycopadienes (tetra-Terpeen) C40H78 |
| Koloniekleur in de stationaire fase | Bleek geel of groen | Oranje-roodachtig of oranje-bruinachtig als gevolg van accumulatie van carotenoïden | |
| Lange keten alkenyl fenolen | Aanwezig | Afwezig | Afwezig |
| Aard van biopolymeren | Zeer lange alifatische ketens kruislings verbonden door etherbruggen en dragende vetzuren esters | Tetraterpenoid kruislings verbonden door etherbruggen | |
De rassen kunnen ook worden onderscheiden op basis van de aard van de biopolymeren in de celwand. De A- en B-rassen bevatten lange alifatische verbindingen kruislings verbonden door etherbruggen. In tegenstelling is de basisstructuur van het biopolymeer van L-ras gebaseerd op lycopadiene kruislings verbonden door etherbruggen. Lange keten alkenyl fenol wordt gedetecteerd in het A-ras. De rol van deze alifatische keten is de oplosbaarheid van het fenolische deel in het lipidische gebied te verhogen, een vereiste voor bescherming tegen biologische en chemische oxidatieve degradatie. De lipiden van B- en L-rassen bestaan uit terpenen die meer resistent zijn tegen bacteriële aanvallen dan zijn de alifatische koolwaterstoffen (Metzger en Casadevall, 1989). Hoewel biochemisch verschillend, leven de verschillende rassen samen in de natuur. Gemengde populaties van alkadiëne en botryococcene rassen zijn gevonden in de Australische meren (Wake en Hillen, 1981). De karakteristieke koolwaterstoffen geproduceerd door rassen A, B en L van B. braunii zijn weergegeven in de respectievelijke tabellen 2a, 2b en 2c. Door een algemeen hoger gehalte aan koolwaterstoffen kunnen rassen A en B superieur worden aan ras L voor commerciële winning van koolwaterstof brandstof.
De belangrijkste karakteristieke koolwaterstoffen, geproduceerd door ras A van B. braunii
| Koolwaterstoffen | Structuur | Positie van de dubbele binding | |
| 1 | C25H48 (Pentacosa-1, 16-diene) |
CH3(CH2)7CH=CH(CH2)13CH=CH2 | 1, 16(Z). 1, 16(E) |
| 2 | C27H52 (Heptacosa-1, 18-diene) |
CH3(CH2)7CH=CH(CH2)15CH=CH2 | 1, 18(Z) 1, 18(E) |
| 3 | C29H56 (Nonacosa-1, 20-diene) |
CH3(CH2)7CH=CH(CH2)17CH=CH2 | 1, 20(Z) 1, 20(E) |
| 4 | C31H60 (Hentriaconta-1, 22-diene) |
CH3(CH2)7CH=CH(CH2)19CH=CH2 | 1, 22(Z) |
| 5 | C29H54 (Nonacosa-1, 20, 22-triene) |
CH3(CH2)5CH=CH-CH=CH-(CH2)17CH=CH2 | 1, 20(Z), 22(Z) |
| 6 | C31H58 |
Nog niet opgehelderd | |
| 7 | C27H51 |
E/Z E/Z CH3(CH2)7CH=CH(CH2)13CH=CH-CH=CH2 |
|
| 8 | C27H48 |
E/Z E E/Z CH3(CH2)7CH=CH(CH2)11CH=CH-CH=CH-CH=CH2 |
|
| (Nr. 7 en 8 zijn de ongebruikelijke koolwaterstoffen, geproduceerd door ras A van de B. braunii geïsoleerd uit Overjuyo meer, Bolivia) | |||
III. Biosynthese en accumulatie van onverzadigde koolwaterstoffen
B. braunii A-ras produceert niet-isoprenoïde koolwaterstoffen alkadiënen en trienes. De structurele gelijkenis (locaties van dubbele bindingen) en stereochemie van alkadiënen lijken op die van oliezuur (18:1, cis-ω9). Deze kenmerken en andere bewijzen suggereren dat oliezuur de directe precursor is van de n-alkadiënen. De intracellulaire concentratie van oliezuur blijft relatief laag tijdens de snelle productie van koolwaterstoffen (bijv., in exponentiële en vroeg lineaire fasen van groei), maar wanneer de productie van koolwaterstof daalt (vertragingsfase) stijgt de oliezuur concentratie fors (Templier et al., 1984). Andere factoren (bijv., het voorkomen van een laatste dubbele binding in de koolwaterstoffen; remming van de productie door de aanwezigheid van dithioerythritol, DET) suggereren dat de synthese van koolwaterstoffen (diënen) verloopt via een rek-decarboxylatie traject in plaats van een head-to-head condensatie traject. In het rek-decarboxylatie mechanisme, oliezuur als een directe precursor is langwerpig door opeenvolgende toevoeging van C2-eenheden afgeleid van malonyl Co-A totdat de juiste ketenlengtes worden bereikt. Deze zeer lange keten derivaten worden vervolgens gedecarboxyleerd om koolwaterstoffen te geven die vrijkomen uit rek-decarboxylatie complex (Templier et al., 1984).
Het rek-decarboxylatie systeem van B. braunii is niet-specifiek en kan zowel oliezuur en elaïdinezuur (18:1, trans-ω9) aanvaarden om te produceren zowel cis en trans diënen. Een isomerisatie systeem bestaat dat oliezuur naar elaïdinezuur converteert. Deze isomerisatiestap is traag in verhouding tot transformatie van elaïdinezuur tot trans alkadiënen, en dit voorkomt de vermeerdering van elaïdinezuur in de algen stammen die produceren trans-diënen. De ontbrekende stammen in trans diënen (Aus stam) zijn niet in staat om elaïdinezuren te produceren uit oliezuur via isomerisatie (Templier et al., 1991a, b). Synthese van zeer lange keten monoenic cis, trans-ω9 vetzuren gebeurt ook via een niet-specifieke rek-decarboxylatie systeem. Dit systeem heeft een grote endogene groep nodig van de daarmee overeenkomende zuren, en het is volledig verschillend van het aspecifieke rek-decarboxylatie systeem dat koolwaterstoffen produceert (Templier et al., 1984). Decarboxylatie is de laatste stap van koolwaterstoffen biosynthese. Decarboxylatie heeft een hoge activatie energie en heeft nodig de aanwezigheid van enkele activerende groep om te vergemakkelijken van de verwijdering van kooldioxide. De vereiste activeringsenergie kan worden geleverd door een β-OH groep die aanwezig is in de lange keten vetzuur acyl derivaten (Yong et al., 1986).
De alkatrienes met een terminal en twee cis-ω7, cis-ω9 onverzadigingen worden gesynthetiseerd door een rek-decarboxylatie mechanisme, dat selectief is. Dit selectieve mechanisme accepteert geen linolzuur (cis-ω6, cis-ω9, 18:2) als precursor. Groei in de aanwezigheid van grote hoeveelheden exogene linolzuur zet niet aan tot de productie van overeenkomstige trienes. Trienes zijn ook onwaarschijnlijk gevormd via desaturatie van overeenkomstige diënen, zoals bevestigd door het voeden van de cellen met radioactief gelabelde diënen. Oliezuur is ook de directe precursor van de trienes. De extra dubbele binding is waarschijnlijk geïntroduceerd op de vroege stadia van rek-decarboxylatie proces, hetzij via directe desaturatie van oliezuur, of desaturatie van zeer lange keten vetzuur acyl derivaten, geproduceerd door verlenging van oliezuur (Templier et al., 1991a).
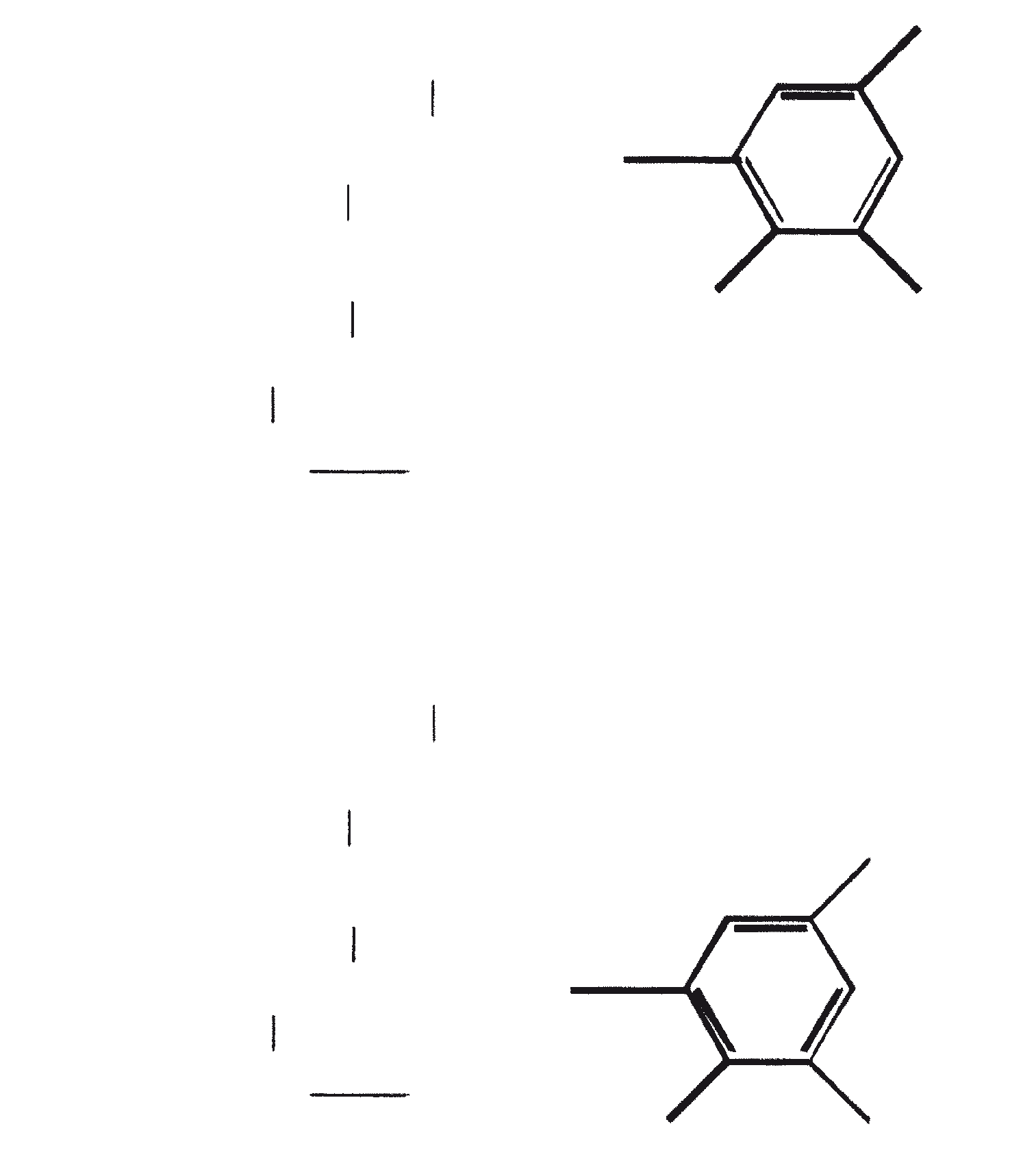
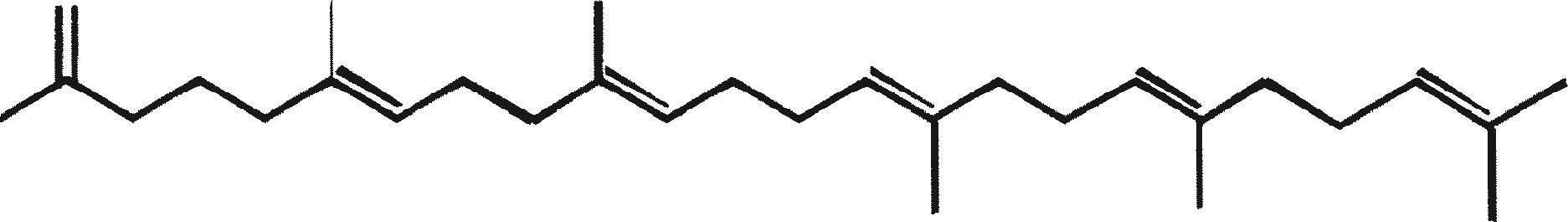
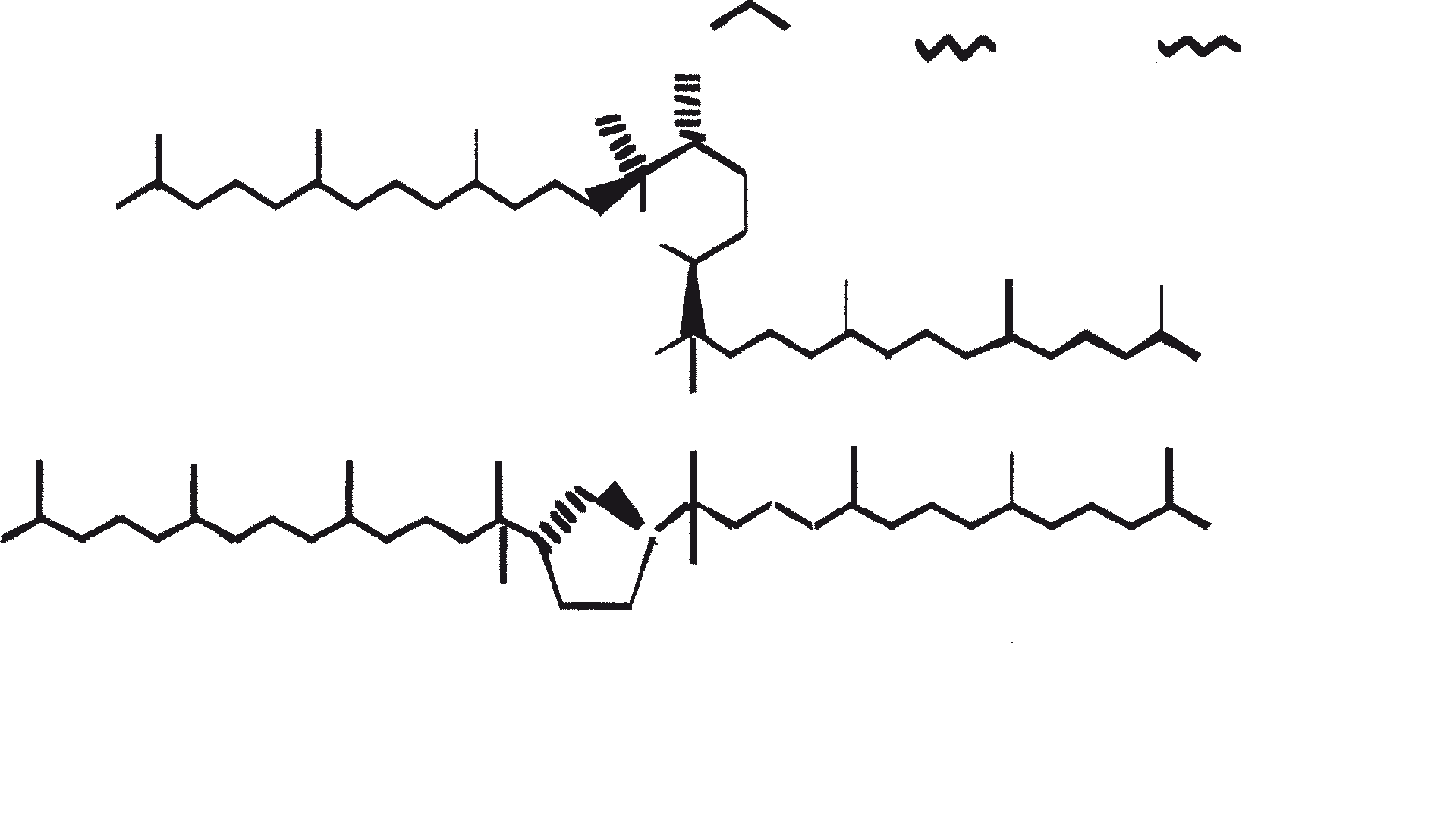
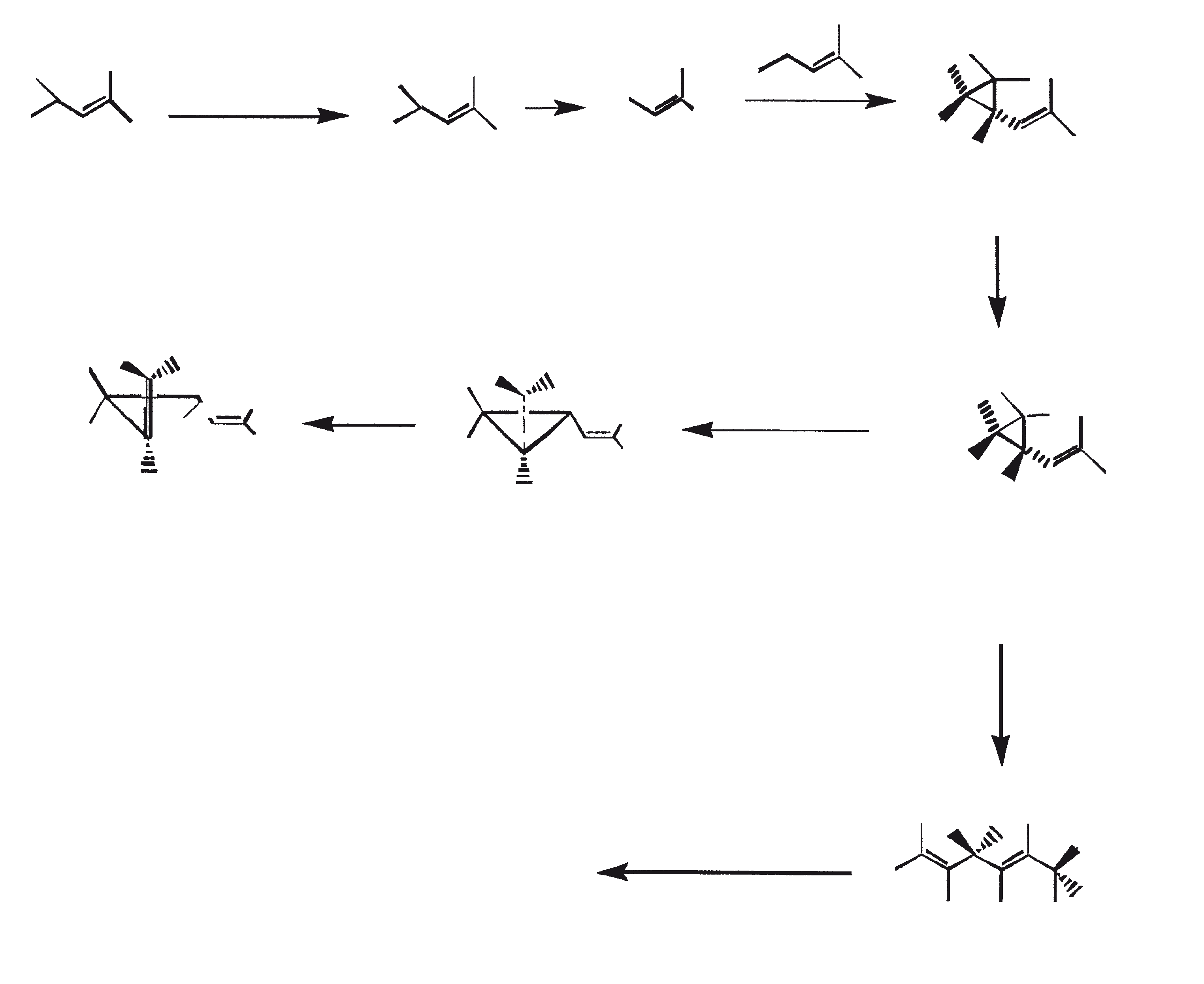
Ras B produceert isoprenoïde verbindingen met een ongewone 1'-3 fusie van isopreen-eenheden in het midden van de keten. Deze verbindingen staan bekend als botryococcenes. Verschillende biosynthetische mechanismen voor botryococcenes zijn voorgesteld. Studies wijzen erop dat de C30 botryococcene, de moedermolecuul voor de hogere homologen, is opgebouwd uit twee moleculen van farnesyl difosfaat, gegenereerd uit farnesol door de actie van farnesol fosfokinase (Inone et al., 1994a, b). Presqualene difosfaat, afgeleid van de farnesyl difosfaat via carbeen toevoeging aan de olefinische dubbele binding (Griessman, 1969), is lid van chrysanthemyl soorten (1'-2-3 fused verbindingen). De cyclopropylcarbinyl kation gegenereerd door het vrijkomen van pyrofosfaat leidt tot 1'-3 (artemisyl), 2-1'-3 (santolinyl), en 1'-1 (head-to-head) structuren. In vitro solvolysis studies suggereren dat 98% van de producten hebben een artemisyl koolstofskelet (Poulter et al., 1977). Wanneer een enkel reactief intermediair kan leiden tot meer dan een product, het overwicht van een specifiek isomeer suggereert de aanwezigheid van een enzym voor het reguleren van de regiochemistry van het tussenproduct.
Botryococcenes behorende tot de artemisyl structuur familie worden gevormd door een herschikking van cyclopropylcarbinyl precursor, in dit geval de C30 kation (R=C11H19), in een reactie beëindigd door de overdracht van hydride van NADH of NADPH aan de allylische kation (Poulter et al., 1977). Squaleen is ook afgeleid van dezelfde precursor via herschikking en hydride vangen, maar 1'-1 fusie. Botryococcenes worden bevoordeeld ten opzichte van squalenes door de meer oppervlakkige breuk van 1'-2 verbinding. Een vergelijking van de biosynthese van botryococcenes en squaleen geeft aan dat de relatieve posities van de C 30 substraat en nicotinamide co-factor vergelijkbaar zijn in het enzym-substraat complex van squaleen synthase en botryococcene synthase (Huang et al., 1988). Een logische gevolgtrekking hiervan is dat de enzymen die deze reacties katalyseren een aantal gemeenschappelijke structurele motieven kunnen delen, inclusief die welke belangrijk zijn voor de substrate binding en mogelijke katalyse.
Mutatie-analyse van aminozuren in domeinen III, IV en V van de squaleen synthase suggereert dat deze regio van essentieel belang zijn voor de enzymactiviteit. Asp219 en Asp223 van domein IV lijken te zijn die verantwoordelijk zijn voor de binding van het werkzame difosfaatdeel van farnesyl difosfaat (FPP) door middel van magnesiumzout bruggen. Tyr171 in domein III is essentieel voor de eerste stap van de reactie. Een opeenhoping van presqualene difosfaat (PSPP) in mutanten van Phe288 van domein V geeft aan dat dit gebied betrokken is bij de tweede stap van de reactie en eventueel in de splitsing van de cyclopropaan ring om 1'-1 koppeling te vormen.
Aan de andere kant vereist een synthese van botryococcenes gemakkelijke ruptuur van de C(1') -C(2') cyclopropaan verbinding (Gu et al., 1998). Een mogelijke verklaring voor de schijnbare discrepantie tussen biomassa accumulatie en squaleen synthase activiteit is dat de kweekcyclus bestaat uit twee groeifasen. De eerste fase zou worden geassocieerd met de celproliferatie en de accumulatie van squaleen voor sterol en membraan biogenese en een beperkte hoeveelheid squaleen voor extracellulaire biopolymeer montage. De vroege inductie van squaleen synthase zou voldoende kunnen zijn voor deze behoefte. De tweede fase van biomassa accumulatie is gecorreleerd met cellenrijping en een toewijding van hun biosynthetische capaciteiten aan de accumulatie van botryococcenes.
Gezien de gemeenschappelijke mechanistische kenmerken, is het niet onredelijk om te denken dat botryococcenes en squaleen kan worden afgeleid uit een squaleen synthase-achtige reactie (Jarstfer et al., 1996; Zhang en Poulter, 1995) gekatalyseerd door een enkel enzym die subtiel wijzigt om één van de twee producten op te brengen; nochtans kunnen er ook twee verschillende enzymen bij betrokken zijn (Figuur 1). Ook kunnen de alternatieve procedures waarbij farnesal en 3-hydroxy-2, 3-dihydrofarnesal (beide afgeleid van farnesol door de actie van farnesol hydratase) fungeren als precursors (aldolcondensatie gevolgd door herschikking of Michael Additie) niet terzijde worden geschoven (Inone et al., 1993).
synthase
(?)
en
NADPH*
Figuur 1. Mechanisme van de biosynthese van botryococcenes en squaleen door B. braunii.
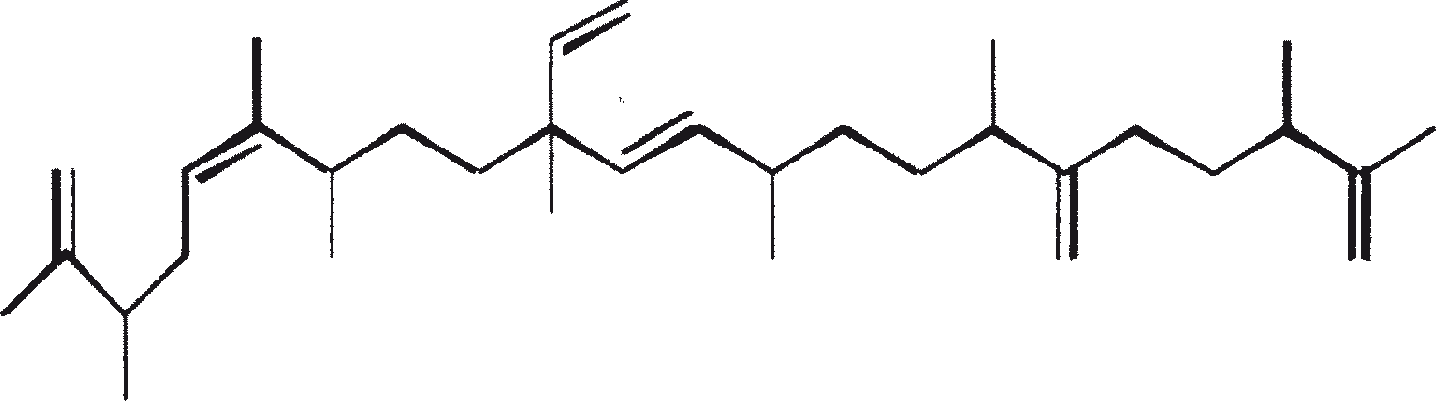
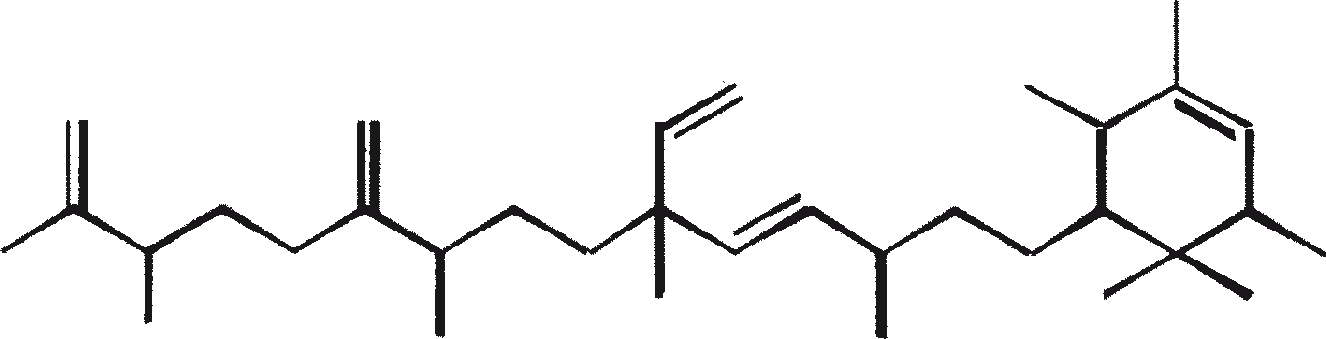
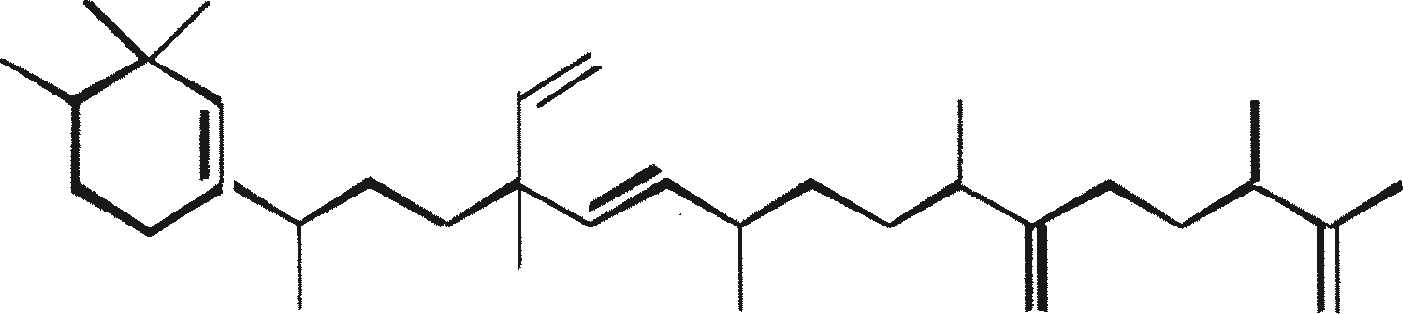
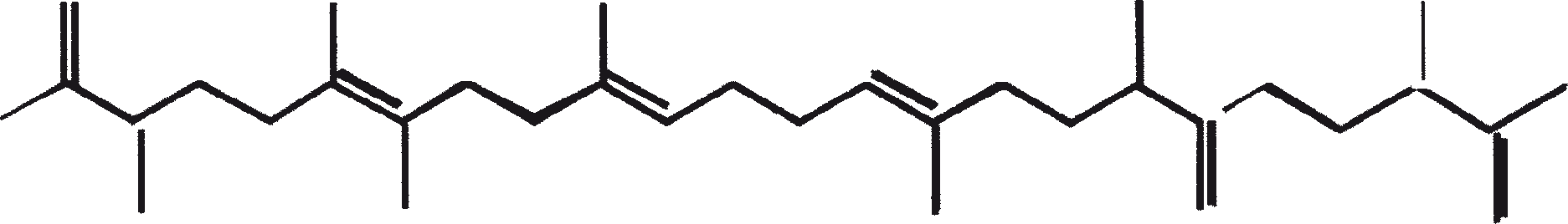
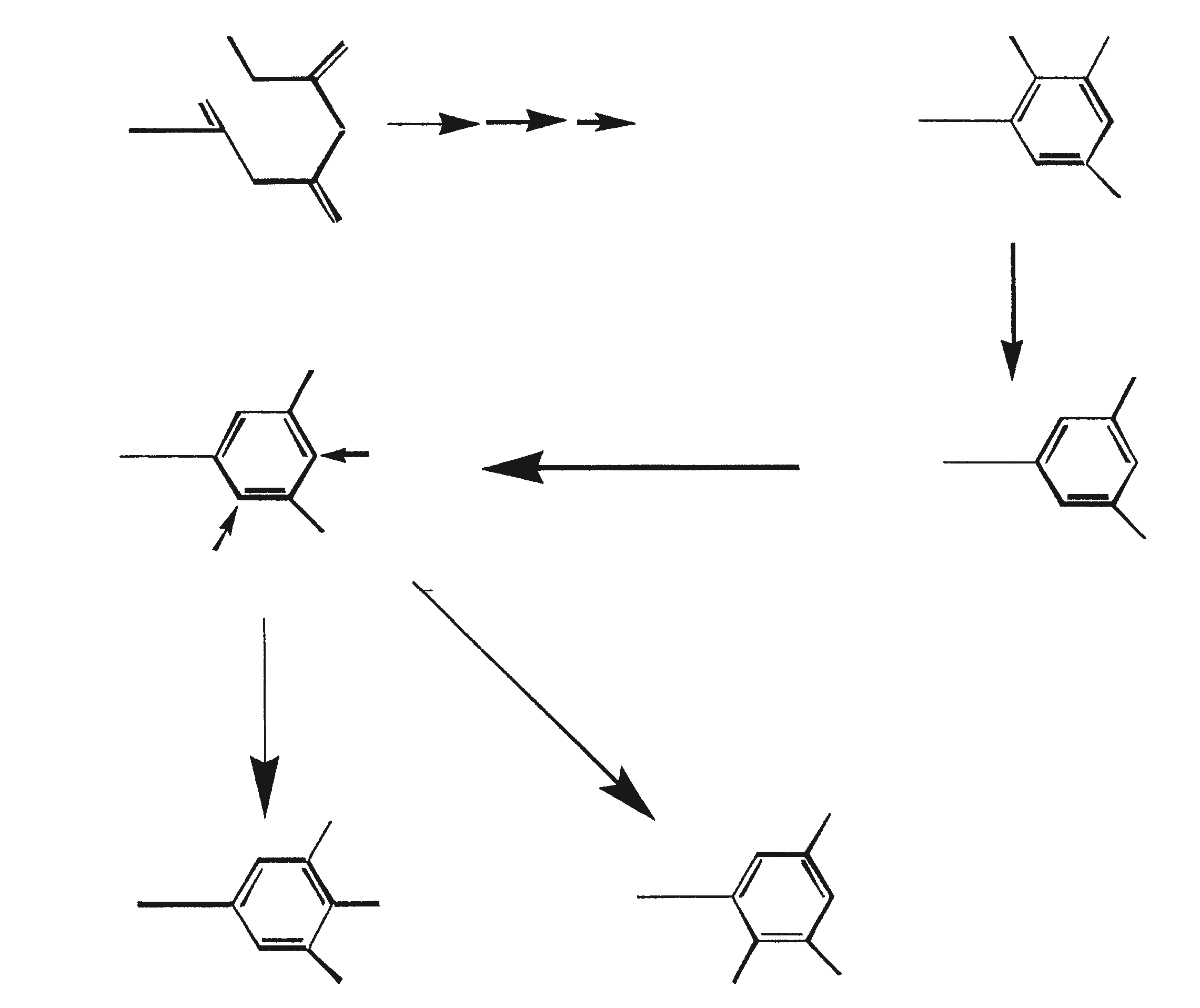
De C30 botryococcene fungeert als de precursor voor hogere botryococcenes. Mono methyleringen treden in de meeste gevallen op de koolstoffen 3, 7, 16, en 20, andere betrokken posities zijn 18 (voor 12), 22 (voor 15) en 30 (voor 16) (Metzger et al., 1985b). S-adenosyl methionine wordt gerapporteerd het methylerende middel te zijn (Wolf et al., 1985b). Puls volg experimenten suggereren dat methyleringen een tegelijk op een opeenvolgende wijze gebeuren, en de reactie gebeurt zowel in de cel en in de extracellulaire matrix (Metzger et al.., 1987). In het licht van de rijkdom van methylatie patronen waargenomen bij deze familie van koolwaterstoffen, is het heel goed mogelijk dat methylases in botryococcene traject laag substraat specificiteit hebben. De alg lijkt niet een grote familie van zeer specifieke methylases te hebben. Dit wordt ondersteund door het feit dat wanneer de cellen worden gekweekt in aanwezigheid van hoge niveaus van methionine, grote hoeveelheden van gemethyleerde squalenes worden geproduceerd. Dit gebeurt omdat aspecifieke methylases omzetten squalenes in methylkwik squaleen, die afwijken van het normale sterol biosynthese en accumuleren met andere koolwaterstoffen (Huang en Poulter, 1989). Cyclische isomeren ontstaan waarschijnlijk als gevolg van alkylering en de daaruit voortvloeiende cyclohexylradicaal kation herschikking aan olefinische structuur (Figuur 2) (David et al., 1988; Metzger et al., 1985b; Murakami et al., 1988).
Biosynthese van lycopadienes wordt verondersteld om te verlopen via staart-naar-staart combinatie van twee phytyl eenheden; echter een lycopersene vermindering mechanisme kan niet worden uitgesloten (Metzger en Casadevall, 1987). Raman spectroscopie en elektronenmicroscopie laten zien dat koolwaterstoffen intern ophopen in cytoplasmatische insluitsels (4%) en extern in opeenvolgende buitenwanden (95%) (Largeau et al., 1980). Ongeveer 2% van de koolwaterstoffen komt voor als vrije bolletjes in het kweekmedium (Largeau et al., 1980). Koolwaterstoffen in de externe groep kunnen worden gewonnen door kort-contact extractie met oplosmiddelen zoals hexaan. De koolwaterstoffen van de externe en interne groep zijn structureel hetzelfde, maar hun relatieve aanwezigheid verschilt in deze groepen. Lange keten koolwaterstoffen overheersen in de externe groep.
Voor het B-ras bestaat een excretie-proces voor botryococcenes uit de cel (Metzger et al., 1987). Hogere botryococcenes (C34, C36, enz.) accumuleren in de externe groep, terwijl de interne groep bestaat uit de lagere homologen (C30, C31, enz.). Naast de bovengenoemde externe en interne groepen waar de koolwaterstoffen onomkeerbaar worden opgeslagen, bestaat een aparte metabole groep. In het A-ras is het aanmaken van alkenyl epoxiden uit de alkadiënen van de metabole groep een normaal verschijnsel. Echter, wanneer de cellen worden geïncubeerd met exogeen alkadiënen, worden steeds grotere hoeveelheden alkenyl epoxide en alkadienones gevormd als gevolg van een abnormaal grote toename in de omvang van de metabole groep veroorzaakt door diffusie van exogene alkadiënen (Templier et al., 1992a).
IV. Celfysiologie en de extracellulaire matrix
De cellen van B. braunii zijn ingebed in een gemeenschappelijke extracellulaire matrix (of “cup”) die is geïmpregneerd met olie en cellulaire exsudaten (Blackburn, 1936). Cellen zijn aan elkaar verbonden door een refringent materiaal dat soms twee of meer afzonderlijke klompen cel verbindt. De wand van elke cel beschikt over een interne fibrillair laag, gemaakt van polysaccharide en een externe trilaminar schede (TLS) (Largeau et al., 1980). Na celdeling verbergt elke cel nieuwe cups in de cup van de moeder cel. Dus lijkt de rubberachtige matrix te zijn samengesteld uit opeenvolgende cups verzadigd met olie. Cellen aan het einde van de exponentiële fase bevatten talrijke chloroplasten met thylakoiden parallel geschikt aan het celoppervlak en zeer weinig zetmeel korrels. Het cytoplasma is gevuld met lipide bolletjes (Metzger et al., 1985a, b).
Tijdens de teelt ondergaat B. braunii een kleurverandering als gevolg van een accumulatie van secundaire carotenoïden (carotenoïden geproduceerd in grote hoeveelheid onder stress-condities zoals stikstof-deficiëntie en hoge lichtintensiteit) in de matrix. De aanwezigheid van carotenoïden is meer uitgesproken in de rassen B en L. In de lineaire fase van groei produceren deze beide rassen nagenoeg gelijke hoeveelheden van β, β-caroteen, echinenone, 3-OH echinenone, canthaxanthine, luteïne, violaxanthine, loroxanthin en neoxanthin. Overwegende dat luteïne de belangrijkste carotenoïde is in de lineaire fase (respectievelijk 22% en 29% van het totaal in de B- en L-rassen), zijn canthaxanthine (46%) samen met echinenone (20% en 28%) de overheersende carotenoïden in de stationaire fase (Grung et al., 1989). Adonixanthin is ook aanwezig in aanzienlijk hoeveelheid in het L-ras in stationaire fase (Grung et al., 1994). De belangrijkste component van de extracellulaire carotenoïden is een ketocarotenoid, echinenone. De kleurverandering is voornamelijk te wijten aan accumulatie van echinenone in de intracellulaire matrix en een gelijktijdige vermindering van het aantal intracellulaire pigmenten (Tonegawa et al., 1998).
Carotenoïde biosynthese volgt hetzelfde traject als botryococcenes’ maar met een hoger koolstof nummer precursor, geranyl-geranyl pyrofosfaat (Poulter en Hughes, 1977). Sommige onlangs geïdentificeerde carotenoïden, bijvoorbeeld botryoxanthin-A (Okada et al., 1996), botryoxanthin-B, en α-botryoxanthin-A (Okada et al., 1998), braunixanthin 1 en 2 (Okada et al., 1997 ) —geïsoleerd van het B-ras kunnnen bijdragen aan de kleur van de algen kolonies. Deze nieuwe carotenoïden zijn structureel verwant aan squalenes.
De buitenwand van B. braunii is samengesteld uit een biopolymeer (9 tot 12% van de droge celmassa) dat zeer resistent is tegen nonoxidatieve chemische degradatie, vooral acetolysis. Het biopolymeer lijkt soms op sporopollenines vanwege hun wijze van depositie, resistente aard, en UV-fluorescentie. Sporopollenines zijn een klasse van biopolymeren van oorsprong uit oxidatieve polymerisatie van carotenoïden en/of carotenoïde esters (Goodway et al., 1973). Sporopollenines maken buitenwanden van sporen en pollen en treden ook op in sommige algen, bacteriën en schimmel celwanden. Echter openbaren IR en 13C NMR studies dat de resistente polymeer van B. braunii niet is afgeleid van carotenoïden en dus niet kan worden beschouwd sporopollenine te zijn. Alle drie de rassen van B. braunii bevatten resistent polymeer en dit polymeer kan de reden zijn voor de vorming van coorongite. Een gelijkenis bestaat tussen de rassen A en B in de aard van de bestanddelen van het biopolymeer.
Lange koolwaterstofketens (tot C31), verzadigd en onvertakt, waarschijnlijk gekoppeld via ether bruggen, maken van de polymere netwerken van resistente polymeren PRB-A (A-ras) en PRB-B (B-ras). Hydroxylgroepen en estergroepen komen ook voor in het biopolymeer, maar ze zijn effectief beschermd door het drie-dimensionale netwerk van koolwaterstofketens. Bijgevolg worden de esters niet beïnvloed door drastische verzeping en zure behandelingen. Zowel PRB-A en PRB-B vertonen een hoog waterstof- en een laag stikstof-, fosfor- en zuurstofgehalte. Vergelijkende analyse laat zien dat zowel PRB-A en PRB-B zijn samengesteld uit C24 tot C30 zeer lange keten vetzuur derivaten (VLCFA) afkomstig van oliezuur. Voedings experimenten en remming met dithioerythritol (DTE) suggereren dat karakteristieke koolwaterstoffen geproduceerd door ras A en PRB-A delen een gemeenschappelijk biosynthetisch traject. Aan de andere kant bestaat er geen biosynthetische relatie tussen de PRB-B en botryococcenes, in het B-ras. Daarom doet lagere labeling van PRB-A zich voor wanneer B. braunii (ras A) wordt geteeld in extern toegevoegd oliezuur (gelabeld), dat wijst op oneigenlijk gebruik van oliezuur naar koolwaterstof productie (Lareillard et al., 1988).
De aanwezigheid van de SC1058 (een cinnolinyl zuur derivaat [1-N-benzyl-3-carboxy-4-keto cinnoline]) in het groeimedium remt de synthese van biopolymeer zowel in de A- en B-rassen. SC1058 is van invloed op de verhouding van de externe en interne lipide groepen. Dit effect is veel meer uitgesproken in geval van A-ras dan B-ras, als gevolg van een sterke relatie tussen de koolwaterstoffen in A-ras en PRB-A biosynthese (Templier et al., 1993). Gesuggereerd wordt dat SC1058 remt de transformatie van VLCFA derivaten naar koolwaterstoffen door decarboxylatie. SC1058 heeft ook invloed op het transport van vetten van interne naar externe groep (Templier et al., 1992b). De belangrijkste bestanddelen van de resistente biopolymeer (PRB-A en PRB-B) zijn botryals, alkenyl epoxiden, alkenyl fenolen, epoxy botryals, alkenyl resorcinols, enz., en de condensatie producten tussen hen en alkadiënen, alkatrienes, of lange-keten vetzuren. Het mechanisme van de biosynthese van PRB-A en PRB-B door B. braunii wordt weergegeven in figuur 3. De celwand-geassocieerde koolwaterstoffen, gevormd door de verschillende rassen van de alg worden getoond in tabel 3.
derivatives
(w9, w23 onverzadigd)
acyl vermindering
toevoeging
polymerisatie
botryalyl ether (11)
condensatie
Figuur 3. Mechanisme voor de biosynthese van PRB-A en PRB-B door B. braunii. De genummerde structuren komen overeen met identiek genummerde stoffen in Tabel 3.
Celwand-geassocieerde koolwaterstof derivaten geproduceerd door verschillende rassen van B. braunii
| Naam | Producerend ras | Structuur | |
| 1 | Botryals C52+xH98+2xO x = 0-12 even aantal |
Ras-A/B | |
| 2. | Epoxy botryals | Ras-A/B | |
| 3 | Alkenyl resorcinol | Ras-A | |
| 4 | Alkenyl pyrogallol | Ras-A | |
| 5 | Alkenyl phenol CxH2x-8O3 |
Ras-A | |
| 6 | Alkenyl epoxiden CxH2x-2O |
Ras-A/B |
| 7 | Botryococcoid ether | Ras-A | |
| 8 | Di-O-alkenyl ether | Ras-A | |
| 9 | Alkenyl-O-alkyl fenol ethers | Ras-A |
| 10 | Alkenyl-O-botryalyl ether | Ras-A/B | |
| 11 | Alkenyl-O-epoxy botryalyl ether. | Ras-A/B | |
| 12 | Triacylglycerol | Ras-A | |
| 13. | Vetzuur | Ras-A | |
| 14 | Trimethyl aldehyde | Ras-A | |
| 15 | Trimethyl vetzuur | Ras-A |
Botryals (1, zoals uiteengezet in tabel 3) zijn even-genummerde C52 tot C64 α-vertakte, α-onverzadigde aldehyden, geproduceerd door aldolcondensatie van even C26 tot C32 enkelvoudig onverzadigde aldehyden. Botryals zijn analoog aan mycolic zuur (α-vertakte, β-OH zuren) gevonden in Corynebacterium (C32-C36), Nocardia (C34-C36) en Mycobacterium (C78-C85) soorten (Metzger en Casadevall, 1989). De trans-isomeer (-CHO groep en omvangrijker groepen zijn trans) overheerst in botryals, welke overeenkomt met het zuur/ base-gekatalyseerde aldolcondensatie mechanisme. Alkenyls fenolen (5), alkenyl resorcinols (3), en alkenyl pyrogallols (4) worden gesynthetiseerd via een gemeenschappelijke traject met een tussentijdse tetraketide (Figuur 4). Deze tussentijdse symmetrische ondergaat decarboxylatie naar resorcinol derivaten die, afhankelijk van de positie van de oxidatie, alkenyl pyrogallols en alkenyl fenolen produceren (Metzger en Pouet, 1995). Deze fenolische moieties beschermen de alifatische ketens in het A-ras tegen de afbraak door bacteriën en schimmels. Epoxidases, die brede substraat specificiteit hebben, zijn verantwoordelijk voor de vorming van epoxiden (6).
Botryococcoid ethers (7) vormen een substantieel deel van de biomassa. Hier is een C27 alkadienyl secundaire alcohol gekoppeld aan de -OH dragende koolstof via een andere brug aan een C27 alkatrienyl keten (7a) of aan een verzadigde n-C24/C26 alkylketens (7b) (Metzger en Casadevall, 1991, 1992). Een biosynthetisch mechanisme voor de vorming van botryococcoid ether door B. braunii is voorgesteld (Figuur 5). Botryococcoid ethers en andere ethers op herhaalde condensatie produceren een netwerk van biopolymeren. Dit mechanisme omvat ring-opening van een geprotoneerd epoxide met specifieke splitsing van C-9'-O binding (Metzger en Casadevall, 1992). Een resistente biopolymeer (PRB-L) komt ook voor in het L-ras. Dit is goed voor een groter deel van de totale biomassa dan PRB-A en PRB-B in A- en B-rassen. PRB-L structuur bestaat uit verzadigde lange (tot C30) koolwaterstofketens waarschijnlijk verbonden via ether bruggen, en het is nauw verwant aan lycopadiene, de enige koolwaterstof geproduceerd door L-ras (Dernne et al., 1989). De aanwezigheid van epoxylycopane (19), lycopanerol-A (20) (Metzger en Aumelas, 1997), lycopanerol B-G (Rager en Metzger, 2000), en alifatisch polyaldehyde tetraterpeen diol polyacetaal (Bertheas et al., 1999) in PRB-L is ook gemeld.
V. Synthese van andere biochemicaliën
A. Exopolysaccharides
Microbiële exopolysaccharides (EPS) trekken veel aandacht vanwege hun talrijke toepassingen. Ook is in sommige gevallen de productie van exopolysaccharides verbonden met pathogeniteit van micro-organismen. Het commerciële nut van de meeste industriële polysacchariden is gebaseerd op hun vermogen om rheologische eigenschappen van oplossingen te wijzigen. Polysacchariden worden veel gebruikt in textiel-producten, wasmiddelen, lijm, papier, verf, en voedingsmiddelen. Veel algen kunnen exopolysaccharides produceren, maar slechts weinig polysacchariden van microalgen worden commercieel gebruikt. EPS geproduceerd door de alg Chlamydomonas mexicana kan worden gebruikt als bodemverbeteraar (Koren en Rayburn, 1984) en EPS gesynthetiseerd door Porphyridium curentum wordt beschouwd als commercieel belangrijk (Anderson en Eakin, 1985).
B. braunii kan exopolysaccharides synthetiseren zoals eerst was gemeld voor het A-ras (Casadevall et al., 1985). Cellen van B. braunii beschikken over een interne fibrillaire laag gemaakt van slijmachtige polysacchariden. Dit polysaccharide lost langzaam op in het kweekmedium, veroorzakend een toename van de viscositeit. De opbrengst van de EPS varieert van 250 g·m-3 voor A- en B-rassen tot en met 1 kg·m-3 voor het L-ras. Galactose is de belangrijkste component van de heterogene polysaccharide. Andere waarneembare componenten van het polymeer zijn fucose, arabinose, rhamnose, uronzuren en ongewone suikers zoals 3-O-methyl fucose, 3-O-methyl rhamnose, en 6-O-methyl hexose. In tegenstelling tot A- en B-rassen wordt glucose gedetecteerd in significante hoeveelheden in de L-ras polysacchariden (Allard en Casadevall, 1990). B. braunii UC58, een stam geisoleerd van een meer in Portugal, produceert grote hoeveelheden EPS (4,0 tot 5,5 kg·m-3) en lage hoeveelheden koolwaterstoffen (5%) (Fernandes et al., 1989). De polysaccharide productie gebeurt zowel tijdens de groei en stationaire fasen, maar hogere productiesnelheden worden gezien als de groeisnelheid afneemt. Deze verhoogde productie wordt geassocieerd met de ontwikkeling van stikstofbeperking in het kweekmedium. Onder stikstoftekort nam het gehalte van de fotosynthetische pigmenten in de cel af, en is de snelheid van de fotosynthese verminderd. Microalgen lijken op deze conditie te reageren door stikstofhoudende macromoleculen af te breken en koolstofreserve verbindingen te accumuleren, zoals polysacchariden en vetten.
Hogere groei en productie van EPS komt voor wanneer nitraat de stikstofbron is in plaats van ureum of ammoniumzouten. Het verbruik van ureum en ammonium veroorzaakt een snelle daling van de pH en dit verklaart de relatief slechte groei en de productie van polymeren bij gebruik van deze stikstofbronnen. De bouillon viscositeit begint te dalen wanneer ureum en ammoniumzouten de stikstofbronnen zijn en de kweek komt in de stationaire fase. Dit suggereert zure en/of enzymatische hydrolyse van het biopolymeer. Tijdens de stationaire fase kunnen polysaccharide hydrolyse-enzymen worden vrijgegeven door cellyse. Nitraat in een concentratie van 8 mM is blijkbaar de optimale stikstofbron voor het verkrijgen van uitgebreide groei (Lupi et al., 1994). Cellen geteeld onder continue-verlichting vertonen een hogere EPS productiviteit (zowel volumetrisch en specifiek) dan cellen gekweekt onder cyclische verlichting (Lupi et al., 1994). Optimale temperatuur voor EPS synthese is 25 tot 30°C, die samenvalt met een optimale temperatuur voor groei. Beneden 25°C neemt EPS synthese af, hoewel goede groei nog steeds kan worden gehandhaafd.
De mate van polymerisatie van het biopolymeer wordt aanzienlijk verminderd als de temperatuur buiten het optimale bereik is. Tijdens batch kweek verandert het reologische gedrag van het medium van Newtoniaans naar niet-Newtoniaans als gevolg van EPS productie tijdens de groei; echter, in lange termijn kweek gaat de reologie terug naar Newtoniaans vanwege hydrolyse van het polymeer (Lupi et al., 1991).
De geassocieerde bacteriën (Auriobacterium barkeri, aanwezig in de niet-axenische stam van B. braunii UC58 geïsoleerd uit Portugal) hebben geen effect op de productie of stimulatie van EPS synthese (Fernandes et al., 1989). Vermoedelijk kan de affiniteit van bepaalde bacteriesoorten voor gesulfateerde glyco-conjugaten blootgesteld op epitheliale cellen van vatbare gastheren worden verminderd door exopolysaccharides van microalgen. Gesulfateerde polysacchariden van microalgen kunnen worden gebruikt in anti-adhesive therapieën tegen bacteriële infecties, zowel in koud- en warmbloedige dieren. De aanhechting van menselijk pathogeen Helicobacter pylori aan de HeLaS3 menselijke cellijn wordt geremd door verschillende polysacchariden van algen (Guzman-Murillo en Ascencio, 2000). Omdat het uronzuur bevat kan het geproduceerde EPS worden gebruikt om metaalionen te chelaten en metaal-geassocieerde toxiciteit te verminderen. Ook is EPS een potentiële bron van fucose, een 6-deoxy suiker, dat een hoogwaardig substraat is in de chemische synthese van smaakstoffen (Lupi et al., 1991).
B. Alkanen
Gemethyleerde aldehyden zijn in de cellen van B. braunii gevonden (Metzger et al., 1991). Deze aldehyden worden gegenereerd uit vetzuren via de methylatie door S-adenosyl methionine en vervolgens omgezet in aldehyden door vetzuur acyl reductase. Dit enzym vereist ATP, CoA en NADH voor zijn activiteit. Vetzuur acyl reductase is opgelost van microsomen met 0,1% octyl β-glucoside en gezuiverd tot homogeniteit door Blue A agarose en palmitoyl CoA agarose affiniteit kolomchromatografie. Het moleculaire gewicht van het enzym werd bepaald op 35 kDa door SDS-PAGE. Het N-terminale deel van het enzym is zeer homoloog met de vetzuur acyl reductase geïsoleerd uit bacteriën (Wang en Kolattukudy, 1995).
De aldehyden gegenereerd uit vetzuren via methylering zijn in verzadigde koolwaterstoffen (alkanen) omgezet. De resulterende alkaan heeft één minder koolstof dan de aldehyden. De conversie van aldehyde naar alkaan via decarboxylatie vereist decarbonylase activiteit onder zuurstofloze omstandigheden. Het decarbonylase enzym is gelegen in het microsoom en het wordt geïnactiveerd door 8-hydroxyquinoline, O-fenantroline en metaal chelatoren zoals EDTA. Inactivatie door metaal chelatoren weerspiegelt de betrokkenheid van metaalionen met de activiteit van het enzym. Aannemelijk is het metaal-ion een deel van het porfyrine complex van het decarbonylase enzym. De inactiviteit van het enzym in de aanwezigheid van zuurstof komt tot uiting in het ontbreken van alkanen als B. braunii wordt geteeld in aërobe omstandigheden.
De decarbonylase van B. braunii kan ook koolmonoxide converteren naar kooldioxide. Deze omzetting van koolmonoxide, niet gemeld bij eerder onderzochte koolwaterstof-synthese-systemen, kan nodig zijn voor organismen die grote hoeveelheden koolwaterstoffen produceren. De decarbonylase heeft een Michaelis-Menten constante (Km) waarde van 65 µM, een vmax van 1,36 nmol·min-1mg-1 en een optimale pH van 7,0 (Dennis en Kolattukudy, 1991).
C. Groeibevorderende stoffen
Extracten van B. braunii biomassa geteeld onder bepaalde voorwaarden hebben een groeibevorderend effect op wortels aangetoond (Murakami, 2000). Bevordering van de groei wordt bereikt bij extractconcentraties vanaf 50 ppm (Murakami, 2000).
VI. Rol van bacteriële associatie in de productie van koolwaterstof
Interacties tussen bacteriën en algen zijn goed gedocumenteerd. Bacteriën kunnen algengroei stimuleren door het vrijgeven van stoffen zoals vitamines en organische chelaatvormers (Haines en Guillard, 1974). Bacteriën kunnen opneembare stikstof derivaten en anorganische voedingsstoffen voor de algencellen produceren (Parker en Bold, 1961). Ook kunnen bacteriën de pH en het redoxpotentiaal beïnvloeden door het produceren van kooldioxide (Parker en Bold, 1961). Bacteriën kunnen ook algengroei remmen door te concurreren voor de beperking van voedingsstoffen, aangezien de voedingsstoffen opname percentages van algen over het algemeen lager zijn dan die van bacteriën (Saks en Kahn, 1979). Bacteriën kunnen algicide afscheiden (Reim et al., 1974), polysacchariden van algen afbreken en algencellen ontbinden (Fallon en Brock, 1979).
De aanwezigheid van een aantal begeleidende micro-organismen in B. braunii culturen was ooit beweerd dat op zijn minst medeverantwoordelijk voor de waargenomen productie van koolwaterstoffen (Murry en Thomson, 1977). Studies van batch culturen van B. braunii kutzing (niet-axenische stam) blijkt dat zowel de totale biomassa en de productie van koolwaterstoffen in het begin van de stationaire fase aanzienlijk lager zijn, wanneer vergeleken met axenische controles (Chirac et al., 1985). Een lagere koolwaterstoffen productiviteit in de aanwezigheid van bacteriën is verbonden met het koolwaterstof-afbrekende vermogen van de bacteriële soorten geassocieerd met algenkweek (vooral Pseudomonas en Flavobacterium sp.) (Chirac et al., 1985). De verschillende microbiële flora geassocieerd met B. braunii zijn vermeld in Tabel 4.
Diverse microbiële flora geassocieerd met B. braunii
| Stam | Bron | Geassocieerde bacteriële soorten |
| B. braunii (Cb) | Cambridge Cultuur Collectie, Engeland | Arthrobacter sp. Corynebacterium sp. Pseudomonas sp. Erwinia sp. Alcaligenes sp. Flavobacterium sp. |
| B. braunii (Gb) | Gottingen Cultuur Collectie, Duitsland | Streptomyces sp. |
| B. braunii (Tb) | Thonon Cultuur Collectie, Frankrijk | Streptomyces sp. |
Specifieke koppelingseffecten zijn onderzocht door co-kweken axenische B. braunii (stam-A) met specifieke micro-organismen zoals Flavobacterium aquatile, Corynebacterium aquatile, Azotobacter chroococcum, en Pseudomonas oleovorans (Jones, 1972). Deze micro-organismen waren geselecteerd om verschillende redenen: F. aquatile en C. aquatile komen vaak voor in het aquatische omgevingen en staan bekend te associëren met B. braunii, A. chroococcum kan stikstof oplossen, en P. oleovorans breekt koolwaterstoffen af. Als gemengde culturen werden belucht met CO2-verrijkte lucht, alleen F. aquatile veroorzaakt verbeteringen in zowel de algenbiomassa en productie van koolwaterstoffen ten opzichte van axenische controles. P. oleovorans veroorzaakt een aanzienlijke daling van algenbiomassa en productie van koolwaterstoffen.
Onder CO2-beperking, de CO2 geproduceerd door bacteriële ademhaling werd gebruikt door de alg voor de fotosynthese. Echter, de hoeveelheid CO2 gegenereerd door bacteriën was aanzienlijk lager dan de algen vraag. De gunstige effecten van CO2-productie compenseerden de schadelijke gevolgen, en alle CO2-beperkte gemengde culturen toonden een aanzienlijke toename van de biomassa en de productie van koolwaterstoffen (Chirac et al., 1985).
Verschillende bacteriën oefenen aanzienlijke invloed uit op de groei opbrengst en koolwaterstofproductie door B. braunii. De precieze effecten zijn afhankelijk van kweekomstandigheden en de betrokken micro-organismen. De aanwezigheid van Bacillus soorten en Corynebacterium soorten kunnen stimuleren koolwaterstof biosynthese. In een geval, de aanwezigheid van Corynebacterium sp. verhoogde het niveau van de koolwaterstoffen van de algenbiomassa van 5,6% tot 24,2% (Wang en Xie, 1996). De aanwezigheid van micro-organismen beïnvloed niet alleen de hoeveelheid koolwaterstoffen, maar ook hun relatieve aanwezigheid. Sommige micro-organismen kunnen het relatieve percentage van synthese van belangrijke koolwaterstoffen door B. braunii wijzigen. Echter, de associatie met micro-organismen is niet essentieel voor de alg om grote hoeveelheden koolwaterstoffen te produceren.
Niet alle bacteriesoorten kunnen gemakkelijk met B. braunii koppelen. Het onvermogen te vormen stabiele koppeling (geopenbaard door een lage populatie van aanverwante soorten) kan meerdere oorzaken hebben, waaronder ongeschikte kweekomstandigheden, het onvermogen van de organische stof die vrijkomt door B. braunii te handelen als een goede voedingsstof voor de groei, en antagonistische effecten van B. braunii (Swale, 1968). In veel gevallen, stabiele koppeling zal zorgen voor een grote toename in algenbiomassa en koolwaterstofproductie, een verminderde vervuiling door andere micro-organismen, en een verbeterde levering van CO2.
VII. Bioreactorkweek van B. braunii
A. Kweekmedium en condities
Veel werk is gedaan tot vaststelling van de optimale voedingsbehoeften en kweekomstandigheden voor de productie van B. braunii koolwaterstoffen. De productie van koolwaterstoffen in de B. braunii lijkt te zijn verbonden aan groei, ongeacht de specifieke kweekomstandigheden en de gebruikte voedingsstoffen. Blijkbaar is de waargenomen trage groeisnelheid van de algen niet het gevolg van een beperkte aanvoer van voedingsstoffen, maar het resultaat van de aanzienlijke inzet van de cellen te produceren energetisch dure koolwaterstoffen.
Net als andere microalgen vereist B. braunii kweek water, licht, CO2, en anorganische voedingsstoffen. Kweekproductiviteit wordt beïnvloed door factoren zoals pH, pCO2, bestralingssterkte, zoutgehalte en temperatuur. Een gewijzigd Chu-13 medium wordt vaak gebruikt om te kweken B. braunii. Dit medium, op vier maal de normale sterkte, heeft de volgende samenstelling (kg·m-3): KNO3 (0,2), K2HPO4 (0,04), MgSO4·7H2O (0,1), CaCl2·6H2O (0,08), ijzer citraat (0,01), citroenzuur (0,1), borium (0,5 ppm), mangaan (0,5 ppm), koper (0,02 ppm), kobalt (0,02 ppm), en molybdeen (0,02 ppm). De pH wordt aangepast tot 7,5 voor de sterilisatie (Largeau et al., 1980).
B. braunii cellen gegroeid in een luminostat kweek in bewerkt Prat medium bereikte een biomassa-concentratie van 3,9 kg·m-3 en had een relatief korte generatie tijd van 3 tot 4 dagen. De specifieke groeisnelheid (μ) tijdens de exponentiële fase was 0,235 d-1. Als de kweek verouderde, het accumuleerde koolhydraten en vetten, maar verloor enkele stikstofhoudende stoffen (Volova et al., 1998).
Fotosynthetische culturen van B. braunii vereisen CO2. Culturen belucht met 0,3% CO2-verrijkte lucht hebben een veel kortere massa verdubbelingstijd (40 h) in vergelijking met 6 dagen voor culturen geleverd met omgevingslucht. CO2-verrijking is gunstig voor de vorming van lagere botryococcenes (C30-C32), terwijl culturen besproeid met de omgevingslucht accumuleren hogere botryococcenes (C33-C34) (Wolf et al., 1985a). Blijkbaar methylatie stappen die leiden van C30 naar C31 en C32 zijn sneller in CO2-verrijkte culturen dan stappen die leiden tot C33, C34 en hogere homologen. Hoewel autotroof, B. braunii maakt gebruik van exogene koolstofbronnen voor een betere groei en productie van koolwaterstoffen. Diverse koolstofbronnen, met inbegrip van C1-C6 verbindingen en disacchariden (lactose, sucrose), zijn gescreend bij pogingen tot daling van de massa verdubbelingstijd van de alg van ≥1 week tot minder dan 2 tot 3 dagen (Weetal, 1985).
Hoewel een tekort aan stikstof gunstig is voor lipide-accumulatie (Ben-Amotz et al., 1985), is stikstof nodig voor groei. Studies met stikstof geleverd als NO3–, NO2–, en NH3 onthullen dat de primaire factor voor reguleren stikstof metabolisme in B. braunii is het nitraat opname systeem. Stikstof wordt over het algemeen geleverd als nitraat zouten. Een eerste NO3 concentratie van ≥0,2 kg·m-3 begunstigd koolwaterstofproductie (Casadevall et al., 1983). Met 1 kg·m-3 KNO3, de koolwaterstofconcentratie na 30 dagen was 4,8 kg·m-3. Ongeveer dezelfde hoeveelheid koolwaterstof (4,5 kg·m-3) werd verkregen als de initiële concentratie van KNO3 was 3 kg·m-3. Dit komt omdat bij hoge concentraties nitraat interfereert met koolwaterstofproductie (Brenckman et al., 1989).
Wanneer de cellen worden blootgesteld aan 5 mM NH4+ gedurende 24 uur, wordt het nitraatreductase enzym inactief. Het gebruik van NH4+ als de stikstofbron zorgt ervoor dat de kweek pH doet afnemen tot minder dan pH 4, en dit is schadelijk voor de cellen. Deze NH4+-gerelateerde toxiciteit manifesteert zich in de late exponentiële fase van groei, en de schade die het toebrengt is onomkeerbaar (Lupi et al., 1994). Fotosynthese en koolwaterstofproductie worden drastisch verminderd wanneer B. braunii (B-ras) cellen worden blootgesteld aan NH3. Totale CO2-fixatie daalt met ongeveer 60% en zuurstof evolutie vermindert met meer dan 50%. Er is echter een duidelijke toename in de synthese van alanine, glutamine en andere aminozuren, met name 5-aminolevulinezuur, een precursor van chlorofyl. Dit duidt op een verlegging van acetyl Co-A van koolwaterstof-synthesetraject naar aminozuur synthesetraject (Ohmori et al., 1984).
Fosfor is nodig voor de groei van B. braunii en het wordt meestal geleverd in de vorm van K2HPO4. Actieve groei houdt aan na volledige uitputting van fosfaat in het medium. In feite kunnen fosfaatniveaus dalen tot beneden de detectielimiet (0,5 g·m-3) vroeg in de exponentiële fase (Casadevall et al., 1985). Veel algen kunnen snel fosfaat absorberen in grotere hoeveelheden dan het vereiste van de cel. Deze overmaat fosfaat wordt opgeslagen als intracellulaire granulen. De cellen gebruiken op deze fosfaatreserve wanneer het extracellulaire fosfaataanbod is opgebruikt.
In de laatste fasen van kweek, een grote hoeveelheid fosfaat kan worden vrijgegeven in het medium als de cellen lyseren. Een verhoging van de oorspronkelijke hoeveelheid fosfaat in het medium, naast het niveau reeds aanwezig in het geconcentreerde Chu-13 medium, heeft geen invloed op de groei, de aard van koolwaterstoffen, en hun relatieve aanwezigheid. Echter is een merkbare verhoging van de hoeveelheid geproduceerde koolwaterstof gemeld in de aanwezigheid van een overmaat fosfaat. Dit ontstaat als gevolg van veranderingen in de N:P verhouding in het medium, en N:P verhouding is bekend te beinvloeden het vetgehalte van verschillende algen (Casadevall et al., 1985).
Studies hebben geprobeerd om het optimale bestralingssterkte niveau te identificeren voor de ondersteuning van de groei en koolwaterstofproductie. Een hoge lichtintensiteit verhoogt verhouding van carotenoïden tot chlorofyl, en dit beïnvloedt de kleur van algen kolonies (Wolf et al., 1985a). Koolhydratenconcentratie, cellulaire stikstof en fosforgehalte van B. braunii UTEX 572 worden verlaagd door langdurige blootstelling aan een lichtintensiteit van 25 tot 72 µE·m-2s-1 (Oh et al., 1997).
Onder intense verlichting (10 klx, of ~140 μE·m-2s-1) algencellen die waren aangepast aan een hoge bestralingssterkte tijdens voorkweek konden een hogere biomassaconcentratie (7 kg·m-3) en koolwaterstofgehalte (50% van het droge gewicht) bereiken in vergelijking met cellen die waren aangepast aan laag niveau bestralingssterkte (3 klx, or ~42 µE·m-2s-1) (Kojima en Zhang, 1999). De lagere productiviteit van donker-aangepaste kweek was omdat het was zeer vatbaar voor photoinhibition. Photoinhibition zou kunnen worden verminderd door gedeeltelijke beschaduwen van de bubblekolom fotobioreactor (Kojima en Zhang, 1999). Biomassaproductie kon worden verdubbeld onder continue-verlichting (24 h) in vergelijking met culturen die een dagelijkse lichtcyclus (12 h licht/12 h donker) ervaarden; maar in vergelijking met de dagelijkse verlichtingcyclus, resulteerde continu licht in een viervoudige toename van koolwaterstofproductie (Lupi et al., 1994).
Kolonieomvang nam toe in eerste instantie met een verhoogde lichtintensiteit wanneer de celconcentratie laag was en voldoende licht voor de fotosynthese beschikbaar was. Als de celconcentratie verhoogde, de gemiddelde lichtintensiteit in de fotobioreactor daalde vanwege wederzijdse beschaduwing (Mirón et al., 1999; Molina et al., 1999, 2000), leidend tot afname van de koloniegrootte. De productiepercentages van extracellulaire polysacchariden en koolwaterstoffen daalde met een daling van de gemiddelde lichtsterkte. Er is gesuggereerd dat het evenwicht van de koloniegrootte wordt bepaald door een dynamisch evenwicht tussen de mechanische sterkte van kolonies en de hydrodynamische stress ten gevolge van turbulentie in de reactoren (Zhang en Kojima, 1998; Chisti, 1999).
De pH van het kweekmedium is over het algemeen aangepast tot een pH tussen 7,4 en 7,6 alvorens oculatie. Een regelmatige stijging van de pH is waargenomen tijdens de actieve groei, gevolgd door een lichte daling later (Casadevall et al., 1985). De toename in pH is deels te wijten aan de consumptie van opgeloste CO2 voor fotosynthese. Vergelijkbare veranderingen in de pH worden vaak waargenomen in de CO2-verrijkte culturen tijdens de exponentiële groei. De optimale temperatuur voor groei is 25°C (Lupi et al., 1991). Natriumfluoride is gevonden groei te stimuleren wanneer het wordt toegevoegd in een concentratie van 0,1 g·m-3 (Wang en Xie, 1996).
De biomassaopbrengst en de cellulaire samenstelling van B. braunii ras A worden beïnvloed door het zoutgehalte (NaCl concentratie) van het kweekmedium. Een lichte stijging van het vetgehalte werd waargenomen als gevolg van toenemende verzilting tot het zoutgehalte gelijk was aan die van zeewater. Een lager dan normaal gehalte aan eiwitten, koolhydraten en pigmenten werden gevonden in cellen gekweekt op 0,5 M NaCl (Ben-Amotz et al., 1985). Hoewel het totale vetgehalte van de cellen constant bleef, de samenstelling van de lipiden veranderde met NaCl concentratie. In de lipide fractie bleef de hoeveelheid koolwaterstoffen, acylglycerol en fosfor constant, maar het hexosegehalte (met name galactose) daalde. Dit werd toegeschreven aan de consumptie van UDP-galactose in de biosynthese van osmoregulatische verbindingen. Er was ook een verandering in de distributie van vetzuren in polaire lipiden, en het aandeel van meervoudig onverzadigde vetzuren was hoger dan de verzadigde vetzuren, wanneer het zoutgehalte verhoogde. Het belangrijkste effect van zout stress was een evenredige verhoging van α-laminaribose (o-β-D-glucopyranosyl-[1-3]-α-D-glucopyranose) gehalte, die fungeert als een osmoprotectant. De concentratie van α-laminaribose is meestal lager in de Gottingen stam dan in de Austin stam van de alg, en dit verklaart de hogere zouttolerantie van de Austin stam. Hoewel de organische osmoregulatische verbindingen (bijvoorbeeld glycerol, glycine) zijn bekend komen voor in algen, de osmoprotectorische activiteit van α-laminaribose werd het eerst gemeld in B. braunii (Vanquez en Bertha, 1991).
Potentieel, huishoudelijk afvalwater dat is voorbehandeld door actief slib behandeling kan worden gebruikt als een medium voor de koolwaterstofproductie B. braunii. Gebruik van afvalwater kan de kosten van het produceren van de koolwaterstoffen verminderen. Secundaire stadium behandeld afvalwater (STS) werd gemonsterd, en bleek een grote hoeveelheid stikstof (als nitraat) en fosfor (als PO43–) te bevatten. Toen B. braunii werd gekweekt op STS belucht met 1% CO2 bij 25°C en zonder controle op de pH, kon het nitraatgehalte worden teruggebracht van 7,67 g·m-3 tot een niveau beneden de detectiegrens (<0,01 g·m-3). De alg was in staat om te consumeren PO43– aanwezig op een heel laag niveau (0,02 g·m-3). NO2– bleek te zijn verbruikt na NO3–, maar NH4+ was niet benut. De groeisnelheid bedroeg 0,35 kg·m-3 per week en het koolwaterstofgehalte was 53% vergeleken met 58% in gewijzigd Chu-13 medium onder dezelfde voorwaarden (Sawayama et al., 1992).
Het gebruik van B. braunii voor tertiaire behandeling van stedelijk afvalwater en de omzetting van de biomassa naar energie kan opwarming van de aarde en eutrofiëring verminderen. Botryococcus kan niet groeien op industrieël afvalwater bevattend een hoge concentratie van anorganische ionen. Er zijn pogingen gedaan om continu biomassa productieprocessen te ontwikkelen met behulp van secundaire fase gezuiverd afvalwater als kweekmedium. Een 2-l continue-flow bioreactor gebruikt op een verdunningssnelheid van 0,57 d-1 bereikte een biomassa productiviteit van 196 g·m-3 per week. De bioreactor werd belucht met 1% CO2-verrijkte lucht (500 ml/min) en continu verlicht op 68 μE·m-2s-1. Onder deze omstandigheden, nitraten en fosfaten daalden van 5,5 g·m-3 en 0,08 g·m-3 tot 4,0 g·m-3 en 0,03 g·m-3, respectievelijk (Sawayama et al., 1994). Potentieel kan de productiviteit van de continu algenkweek worden verbeterd door het optimaliseren van de verdunningsnelheid. De optimale verdunningssnelheid wordt verwacht af te hangen van de sterkte van het afvalwater en de intensiteit van de verlichting. De productiviteit kan verder worden vergroot door het kweken van de cellen op een optimale licht-donker cyclus frequentie (Molina et al., 1999, 2000, 2001).
B. braunii groeide goed en was de dominante soort in gemengde culturen van andere bacteriën en algen (speciaal Oscillatoria) wanneer gekweekt op afvalwater van varkens in een openlucht fotobioreactor. Bij 25°C, de verwijderingspercentages van chemisch zuurstofverbruik (COD), de totale opgeloste koolstof (TDC), totale stikstof en fosfor waren respectievelijk 0,83, 0,61, 0,69, en 0,16 g·m-3 per dag. Het vetgehalte van de algen gekweekt in afvalwater van varkens en het gewijzigde Chu-13 medium waren respectievelijk 32,8 ± 3,2% en 33,2 ± 2,6% (Lee et al., 1999).
B. Fotobioreactoren gebruikt voor de teelt
Veel soorten fotobioreactoren zijn beschikbaar voor het kweken van microalgen (Molina et al., 1999; Mirón et al., 1999, 2000), en de meeste daarvan zijn geëvalueerd voor B. braunii kweek. Batch- en continue-schema's voor bewerking zijn getest in open en gesloten (axenische) bioreactoren. Omwille van de economische haalbaarheid, is alleen continue-kweek realistisch haalbaar voor de grootschalige productie van algen biomassa. Een commercieel levensvatbaar continue-kweekproces moet een hoge dichtheid van biomassa bereiken, of de biomassa productiviteit zal onaanvaardbaar laag zijn. Omdat lichtpenetratie in dichte culturen van microalgen zeer beperkt is, alleen dunne kanaal vlakke plaat fotobioreactoren en smalle doorsnede tubulaire bioreactoren zijn waarschijnlijk bevredigend voor commerciële productie. De kanaaldiepte en buisdiameter in dergelijke reactoren zouden in het algemeen ≤10 cm zijn. Hoewel dunne kanaal vlakke plaat soorten van fotobioreactoren bekend staan als zeer efficiënt, zijn ze niet gemakkelijk opgeschaald naar formaten die nodig zullen zijn voor de productie van aanzienlijke hoeveelheden koolwaterstoffen uit B. braunii. Dit versmalt de keuze tot buisvormige fotobioreactoren. Over het algemeen hebben buisvormige fotobioreactoren hoge biomassa productiviteiten in gesloten culturen van microalgen geboden (Molina et al., 1999; Acién Fernández et al., 2001). Buisvormige bioreactoren vereisen een groot landoppervlak voor een bepaald reactorvolume, en dit is een belangrijk nadeel.
Bubblekolommen en airlift reactoren die compacter zijn dan buisvormige apparaten kunnen belangrijke voordelen bieden voor grootschalige kweek als een bepaald verlies aan productiviteit is aanvaard (Mirón et al., 1999, 2000). Continu kweek in airlift bioreactoren (Chisti, 1989; Acién Fernández et al., 2001; Mirón et al., 1999, 2000) is vaak vooral gebruikt voor het produceren van B. braunii op kleine schaal (Casadevall et al., 1985; Bailliez et al., 1988). Maximale fixatie van CO2 en koolwaterstofproductie door de alg werden gerapporteerd in een bubblekolom fotobioreactor. De buis (7 cm diameter) was gemaakt van glas, en het had een conische bodem. De kweek werd belucht met 1% CO2-verrijkte steriele lucht met een snelheid van 0,5 vvm. Verlichting werd geleverd met behulp van halogeenlampen geïnstalleerd aan de ene kant van de reactor. De lichtsterkte was 10 klx (ongeveer 140 μE·m-2s-1). De reactor kon deels worden beschaduwd door een aluminium folie gewikkeld op het bovenste gedeelte. Dit bereikte een bepaalde licht-donker cyclus frequentie (Molina et al., 1999, 2000, 2001; Mirón et al., 1999), om te proberen te verlichten photoinhibition (Casadevall et al., 1985). Een biomassaconcentratie van 7 kg·m-3 werd bereikt, en de koolwaterstoffen vormden 50% van de droge celmassa. Bubblekolommen zijn geclaimd de cellen onderwerpen aan een mindere hydrodynamische stress dan op dezelfde manier geconfigureerde airlift fotobioreactoren (Kojima en Zhang, 1999), maar dit is discutabel.
Vergeleken met gesloten aseptische kweekvaten, open vijver reactoren kunnen een middelmatige oppervlakte-tot-volume verhouding leveren tegen een veel lagere kosten-per-eenheid volume (Weissman et al., 1988). Echter, de kweekomstandigheden in open systemen zijn minder goed gecontroleerd dan in gesloten fotobioreactoren en, bijgevolg, de biomassa productiviteit is laag in vergelijking met gesloten reactoren. Ook bevatten open kweeksystemen onvermijdelijk gemengde populaties en niet alleen de gewenste alg. Ondanks deze problemen, open kweeksystemen, zoals de “raceway” vijvers kan het meest realistisch zijn voor de productie van grote hoeveelheden van B. braunii voor de winning van koolwaterstoffen. Dit zou vooral zo zijn als een goedkope bron van CO2 kan worden gevonden om te omzeilen de relatief lage efficiëntie van het CO2-gebruik van open kanalen en vijvers.
VIII. Gebruik van geïmmobiliseerde algencellen
Gebruik van geïmmobiliseerde celkweek biedt belangrijke voordelen ten opzichte van vrije schorsing kweek vooral wanneer de cellen langzaam groeien. Extracellulaire producten kunnen continu worden gewonnen vanuit geïmmobiliseerde cel systemen. Immobilisatie staat hergebruik van de biomassa toe en vergemakkelijkt de scheiding van biomassa uit de schorsing van vloeistof. Ook kan immobilisatie cellen beschermen tegen hydrodynamische shear-krachten, en dit kan belangrijk zijn omdat microalgen shear-gevoelig kunnen zijn (Chisti, 1989, 1999). In het licht van deze factoren, immobilisatie schema's zijn onderzocht voor gebruik met B. braunii culturen.
Immobilisatie in calciumalginaat parels resulteert in cellen met verbeterde chlorofylgehalte en fotosynthese-activiteit ten opzichte van vrije besturing. Dit gedrag wordt gezien in alle stadia van een batch kweek onder continue-verlichting. Immobilisatie vermindert de bestralingssterkte gezien door de cellen, en zij reageren door het versterken van het chlorofylgehalte in pogingen om meer van het beschikbare licht te vangen. Ook de gel-ingesloten cellen zijn beschermd tegen photoinhibition, een aandoening waarbij intense straling eigenlijk veroorzaakt een verlies in fotosynthetische prestaties (Molina et al., 1999; Mirón et al., 1999).
Alginaat gel-geïmmobiliseerde cellen hebben een lagere groei en lagere biomassaproductie ten opzichte van vrije besturing. Dit is waarschijnlijk omdat immobilisatie kan verminderen toegang van voedingsstoffen tot de cellen en de immobilisatie matrix heeft een kolonie-beperkend effect. Geïmmobiliseerde cellen behouden de mogelijkheid om koolwaterstoffen te produceren, waarvan de structuur en relatieve aanwezigheid niet worden beïnvloed door immobilisatie (Bailliez et al., 1986). In sommige gevallen is een opmerkelijke stijging van de koolwaterstofproductie (+20% in vergelijking met vrij cell systeem) geregistreerd voor geïmmobiliseerde cellen, wat suggereert immobilisatie gerelateerde verlegging van metabole traject in de richting van koolwaterstof-synthese (Bailliez et al., 1985).
Immobilisatie door occlusie in polyurethaanschuim (PUF) is gebruikt voor B. braunii cellen. PUF ondersteuning matrices zijn veelzijdig vanwege hun brede scala van porositeit en mechanische eigenschappen. De immobilisatie van B. braunii cellen in PUF via entrapment heeft in sommige gevallen geleid tot verminderde fotosynthese-activiteit en koolwaterstofproductie. Voedingsstof- en diffusiebeperkingen zijn kennelijk niet de oorzaak van verminderde prestaties (Bailliez et al., 1985), maar lichtbeperking is een plausibele verklaring. Een studie van PUF-geïmmobiliseerde Anabaena variabilis verbonden de waargenomen slechte performance met de toxische aard van de matrix. PUF matrix kan vrijgeven wateroplosbare toxische stoffen (Gudin en Thomas, 1981). Ook verhoogde lokale temperatuur en druk in de matrix kunnen een verklaring zijn van de slechte resultaten. Sommige schuim-matrix geïmmobiliseerde culturen kunnen ervaren een aanzienlijke lekkage (bijv., ~30%) van cellen (Bailliez et al., 1988). Een studie merkte op dat de koolwaterstofproductie van schuim-geadsorbeerde culturen was vergelijkbaar met die van vrij zwevende cellen gekweekt in een airlift fotobioreactor voor 3 weken (Bailliez et al., 1988). De gemiddelde grootte van de schuim-geadsorbeerde koloniën bleven erg klein en stonden toe betere winning van koolwaterstoffen uit de kweek door solventextractie (Bailliez et al., 1988).
In een geval, katoengaas-geïmmobiliseerde B. braunii cellen vertoonden hogere niveaus van koolwaterstofproductie, biomassa-groei en fotosynthese-activiteit vergeleken met geïmmobiliseerde cellen in PUF (Yang en wang, 1989). Ondanks de voordelen, de haalbaarheid van geïmmobiliseerde algenkweek blijft twijfelachtig, tenzij de cellen kunnen worden gekweekt in lange-duur continue-kweek en de koolwaterstoffen continu kunnen worden geëxtraheerd.
IX. Verdere verwerking
A. Koolwaterstofwinning
Productwinning van fermentatie- en celkweeksystemen vereist meestal een serie van eenheidsbewerkingen die vaak de economische levensvatbaarheid van een productieproces beheersen (Chisti, 1998). De selectie en het ontwerp van een winningsschema houdt verband met de aard van het bronorganisme en de eigenschappen van het product. Biomassaproductie tegen een lage kostprijs kan een diepe impact hebben op de totaalkosten van productwinning (Belarbi et al., 2000), in het bijzonder als het product niet uitgebreid hoeft te worden gezuiverd.
Zodra de B. braunii biomassa is gewonnen uit de bouillon door filtreren of centrifugeren, de koolwaterstoffen kunnnen worden gewonnen, hetzij door uitpersen of door de oplosmiddel extractie van de biomassa. Uitpersen de oliën is geprobeerd op laboratoriumschaal, maar er is geen informatie beschikbaar over de mate van uitwinning. Omdat B. braunii een dikke celwand heeft en de natte biomassa-pasta 10 keer meer water dan koolwaterstoffen bevat, is uitwinning door persen niet efficiënt. Ook kan deze winningsmethode niet worden toegepast op continue-kweek van geïmmobiliseerde cellen.
Oplosmiddel-extractie van biomassa kan de koolwaterstoffen verwijderen zonder de cellen te beschadigen als het gebruikte oplosmiddel niet giftig is. Bovendien moet het gekozen oplosmiddel de volgende eigenschappen hebben: het oplosmiddel moet mengbaar zijn met water; het moet bij voorkeur het product van belang oplossen; het moet een laag kookpunt hebben voor het gemak van de verwijdering; het moet een dichtheid hebben die significant verschillend is van water; het moet gemakkelijk verkrijgbaar en goedkoop zijn; en het moet herbruikbaar zijn. In het licht van deze overwegingen lijkt hexaan het oplosmiddel van keuze voor extractie van algen-koolwaterstoffen (Frenz et al., 1989a, b). Voor een efficiënte winning, moeten de cellen eerst worden geconcentreerd tot een pasta, omdat de aanwezigheid van te veel water rondom de cellen vermindert contact van het niet-polaire oplosmiddel met de buitenste celwand waar de koolwaterstoffen zijn opgeslagen.
Onder geschikte omstandigheden kan 70% van de koolwaterstoffen worden vrijgegeven bij 30 min contact met hexaan. Groei en koolwaterstofproductie worden niet beïnvloed door herhaalde extractie met hexaan. In feite is een hoger gehalte aan koolwaterstoffen waargenomen in hexaan-behandelde biomassa ten opzichte van controles. Uitwinningsrendementen worden beïnvloed door de fysiologische status van de kweek. In een geval, cellen in het begin van de exponentiële groeifase stonden toe meer uitwinning van koolwaterstoffen indien gekweekt in een airlift fotobioreactor in vergelijking met kweek in standaard geroerde bioreactor (Frenz et al., 1989a). Dit effect werd verklaard door de kleinere gemiddelde omvang van de kolonies in het geroerde vat (Frenz et al., 1989a). De kleinere gemiddelde kolonie grootte in de geroerde tank werd waarschijnlijk veroorzaakt door een hogere turbulentie in de tank dan in de airlift reactor (Chisti, 1999).
Opschaling van winning kan moeilijk zijn omdat de algen de neiging samen te voegen en vormen klonten tijdens winning. Dit gebeurt vanwege de verschillen in polariteit van het oplosmiddel en de natte cellen. Samenklontering schermt een groot deel van de biomassa af van blootstelling aan oplosmiddelen. Agitatie op hoge snelheid kan dit probleem verhelpen, maar intense agitatie beschadigd de cellen (Chisti, 1999). Ook kan hevige agitatie vrij duur zijn voor grootschalige commerciële activiteiten.
Koolwaterstoffen kunnen voortdurend worden teruggewonnen van geïmmobiliseerde cellen. Uitwinningsopbrengsten zijn sterk toegenomen ten opzichte van vrij zwevende besturingen wanneer de cellen worden geïmmobiliseerd door adsorptie in polyurethaanschuim (PUF). Omdat de kolonies zijn aan het oppervlak van de immobilisatie matrix, zijn ze gemakkelijk te bereiken door het oplosmiddel. Optimale contacttijd bleek 30 min bij het extraheren met hexaan (Frenz et al., 1989a, b).
Superkritische vloeistoffen (SCF) extractie is een andere technologie die is toegepast op B. braunii (Mendes et al., 1995). Vanwege de relatief lage waarden van viscositeit, dichtheid, en oppervlaktespanning, superkritische vloeistoffen zoals CO2 laten een snelle winning van vaste stoffen toe. Superkritisch CO2 is niet giftig, goedkoop, gemakkelijk te verwijderen van het extract, en te hergebruiken. Een relatief lage waarde van de kritische temperatuur laat gebruik van CO2 voor de extractie van thermolabiele verbindingen toe. In de winning van algen-koolwaterstoffen met CO2 bij 30°C, de oplosbaarheid van koolwaterstoffen werd waargenomen toe te nemen met toenemende druk (Mendes et al., 1995). Het hoogste percentage van extractie was verkregen bij een druk van 30 MPa (Mendes et al., 1995).
B. Omzetten van algen-koolwaterstoffen en olie-rijke biomassa tot brandstoffen
Koolwaterstoffen verkregen in het hexaan-extract van B. braunii kunnnen direct worden verbrand; maar voor betere prestaties in verbrandingsmotoren moet de olie worden aangepast door processen zoals pyrolyse en katalytisch kraken.
Natte en droge algenbiomassa kunnen worden blootgesteld aan direct thermochemische vloeibaarmaking om brandbare olie te produceren. Thermochemische vloeibaarmaking voor 1 h (300°C, 10 MPa druk) in de aanwezigheid van 5% Na2CO3 als katalysator zorgt voor een goede opbrengst van olie (Sawayama et al., 1999). Deze olie kan worden gefractioneerd door silicagel kolomchromatografie in drie fracties, als volgt: (1) een laag moleculair gewicht (197 tot 281 Da) fractie gevormd door de afbraak van botryococcenes (C17-C22 koolwaterstoffen), vormend ongeveer 5% van het totaal; (2) Botryococcenes met molecuulgewichten van 438 tot 572 Da, die vormen 27,2% van de olie; (3) Polaire stoffen (867 tot 2209 Da molaire massa) geproduceerd uit organisch materiaal, andere dan koolwaterstoffen en vormen 22,2% van de olie (Inoue, 1994). Thermochemisch vloeibaar maken van biomassa elimineert de noodzaak voor de eerste solventextractie voor de winning van koolwaterstoffen. Echter, de totale opbrengst van olie uit vloeibare biomassa is laag (52,9%) in vergelijking met een opbrengst verkregen door hexaan extractie (Dote et al., 1992). Natuurlijk is de thermochemische verwerking van biomassa niet van toepassing op continue-kweekoperaties waar alle biomassa wordt bewaard in het kweekvat en winning van koolwaterstoffen voortdurend gebeurt in situ (Frenz et al., 1989a, b).
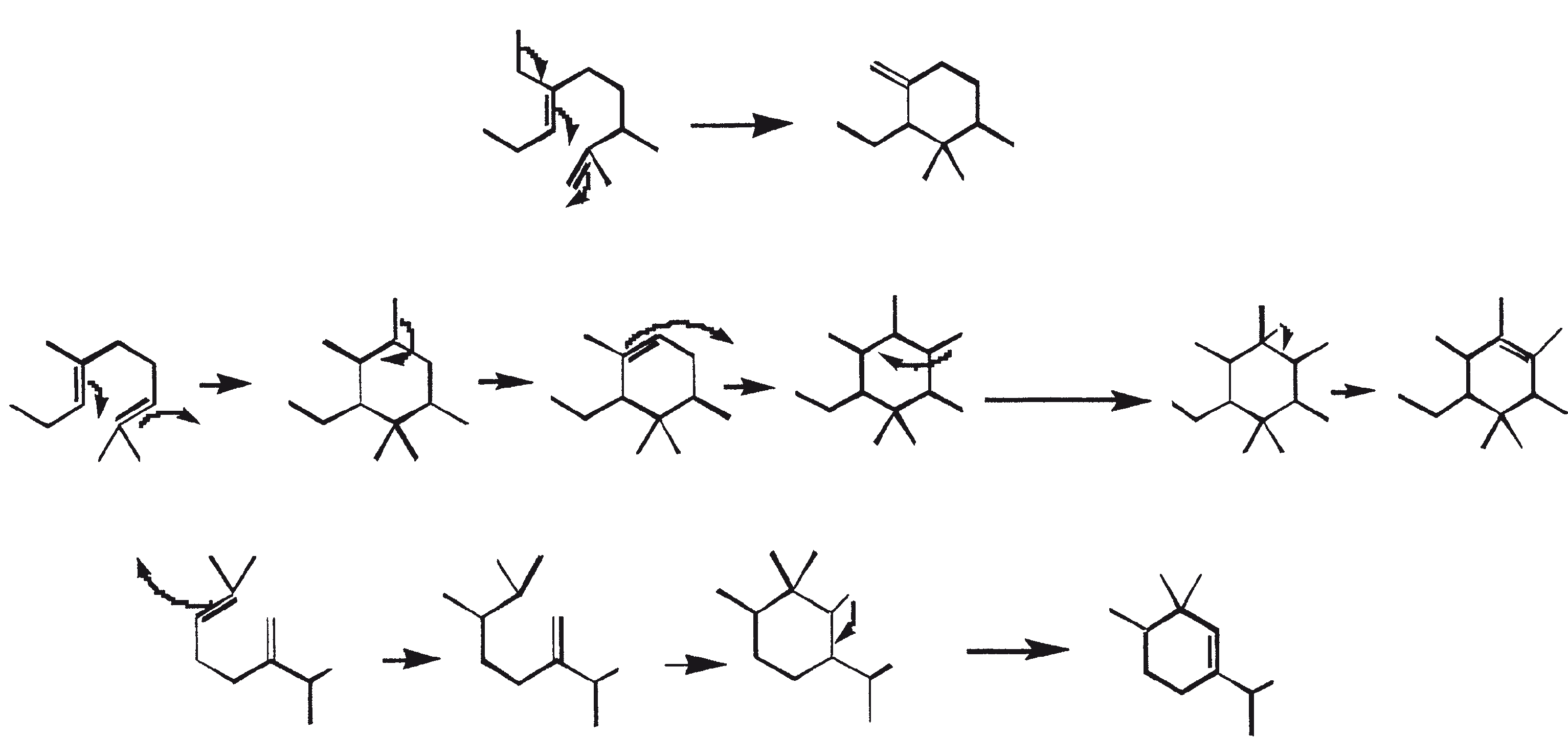
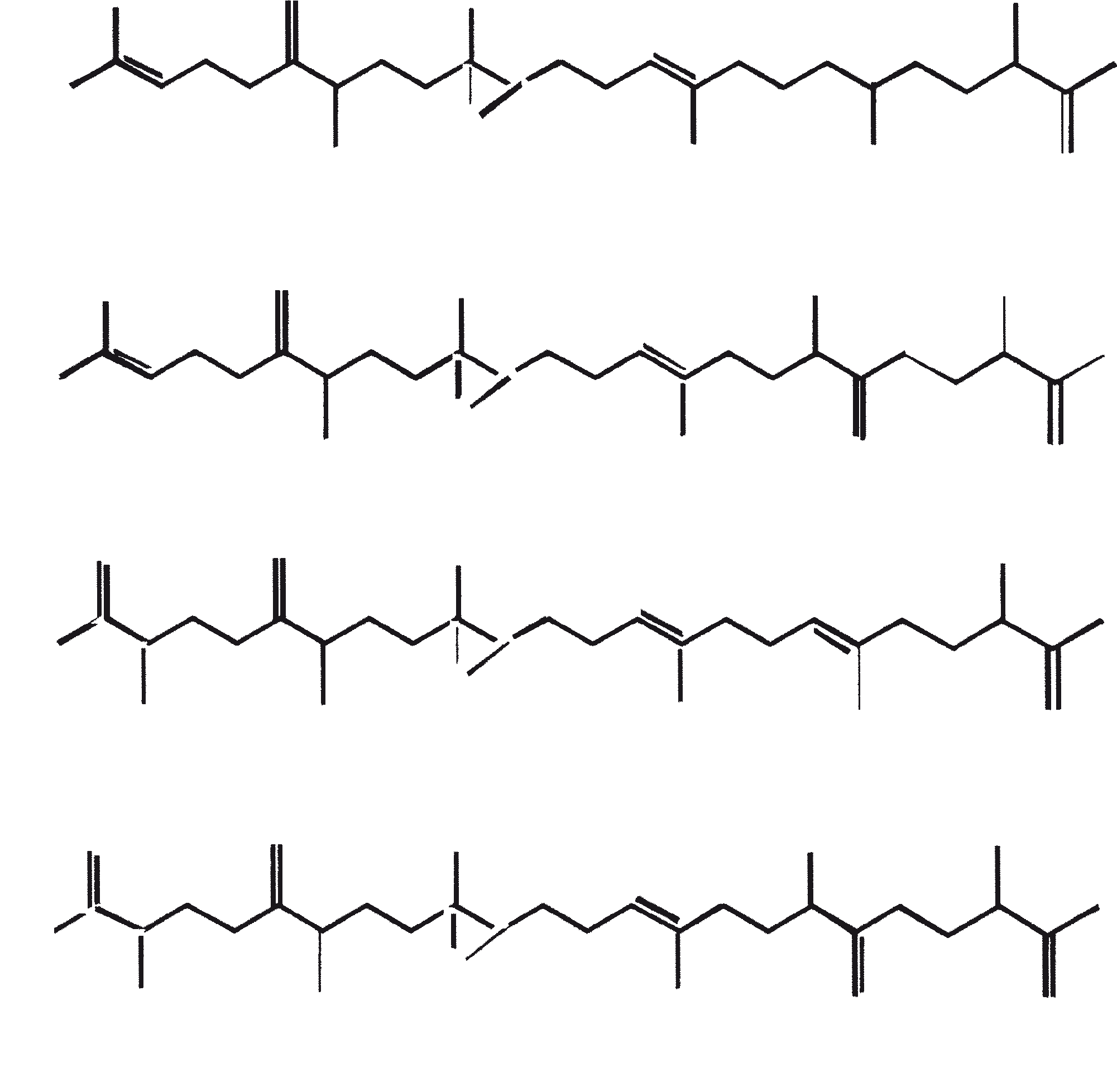
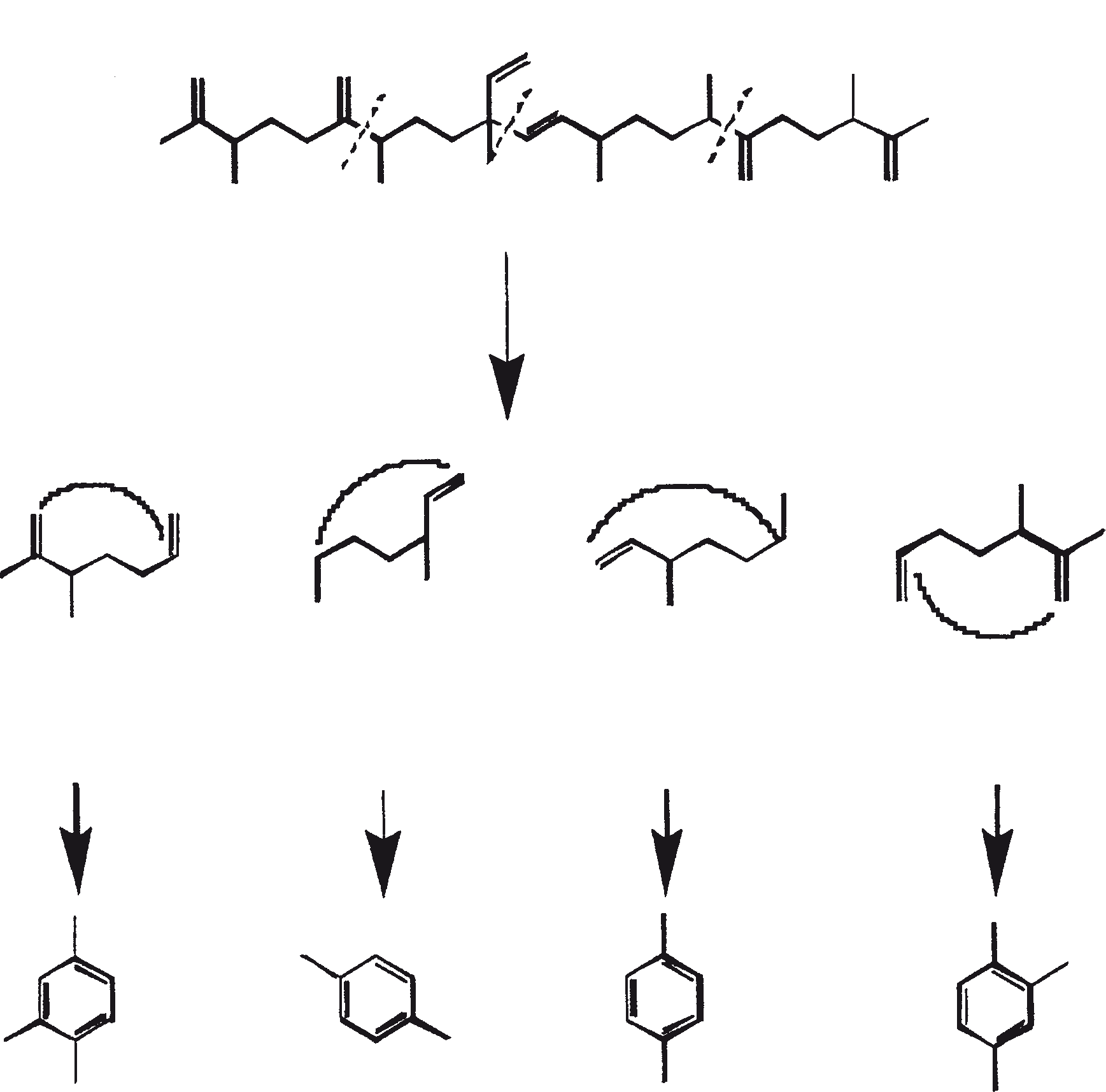
Ruwe koolwaterstoffen van B. braunii kunnen worden omgezet in benzine (60 tot 70%), light cycle olie (10 tot 15%), heavy cycle olie (2 tot 8%), en cokes (5 tot 10%) door de ruwe olie te onderwerpen aan katalytisch kraken (Kitazato et al., 1989). Een verscheidenheid van kraak katalysatoren kunnen worden gebruikt, inclusief CoMo katalysator (Held et al., 1985) en zeolieten (Kitazato et al., 1989). Rendement van benzine en andere fracties hangt af van de katalysator en de reactietemperatuur. De optimale conversietemperatuur met zeoliet-katalysator is 497°C. De opbrengst van benzine verkregen door katalytisch kraken van algen-koolwaterstoffen zijn vergelijkbaar met de opbrengsten verkregen uit aardolie. Ook heeft de geproduceerde benzine een voldoende hoog octaangetal voor direct gebruik in auto's. Hoge octaangetallen resulteren vanwege de vorming van alkylbenzenen, voornamelijk xylenen en trimethylbenzenen. Deze aromatische koolwaterstoffen zijn afkomstig van botryococcenes (voornamelijk de C34H58 verbinding) rechtstreeks via opeenvolgend kraken of cyclo-aromatisatie (Kitazato et al., 1989). Figuur 6 biedt een mechanistische vertegenwoordiging van katalytisch kraken van botryococcene, C34H58. Een zeer specifieke oxidatie van de vinyl dubbele binding in botryococcene (C34H58) is gebruikt om deze verbinding te converteren naar botryococcone, C34H58O, een methyl-keton (Chisti, 1980).
X. Klonen van de koolwaterstofgenen
Slechts een paar rapporten bestaan over het klonen van B. braunii genen in andere organismen. Onlangs werd een 366-bp cDNA-fragment verkregen uit het B-ras met behulp van reverse-transcriptase/polymerase-kettingreactie (PCR) en gedegenereerde primers op basis van geconserveerde aminozuur-reeksen die worden aangetroffen in alle squaleen synthase enzymen. Met behulp van dat vermeende squaleen synthase fragment als een sonde, werd een 2632-bp cDNA-kloon geïsoleerd uit een cDNA-bibliotheek. De cDNA bevatte een open reading frame (ORF) dat codeert voor een eiwit met 461 aminozuren en een moleculaire massa van 52,5 kDa. Een vergelijking van Botryococcus squaleen synthase (BSS) gen met dat van andere organismen toonde een 52% homologie met Nicotiana tabacum, 51% met Arabidopsis thaliana, 48% met Zea mays, 40% met rat, 39% met Saccharomyces cerevisiae, en 26% met Zymomonas Mobilis (Okada et al., 2000).
De hele ORF regio van BSS werd versterkt door PCR met behulp van een forward primer met NdeI restriction site en een startcodon en een reverse primer met BclI site en stopcodon om een 1403-bp fragment te genereren. Een carboxyl-terminus afgeknotte BSS van 1325 bp werd ook gegenereerd door PCR met dezelfde forward primer en een andere reverse primer. De expressie van volledige-lengte en carboxyl-terminus afgeknotte BSS in E. coli BL21 in aanwezigheid van isopropyl thio-β-D-galactoside (IPTG) resulteerde in een aanzienlijke mate van squaleen synthase enzym-activiteit, maar geen botryococcene synthase activiteit.
Squaleen synthase is een endoplasmatisch reticulum-geassocieerd enzym met het carboxyl-terminus geketend het enzym aan het ER membraan (Robinson et al., 1993). De associatie met ER belemmert de conventionele zuivering van het enzym. RNA blot hybridisatie analyse van algenculturen gaven preferentiële expressie van BSS-gen aan tijdens snelle groei. Southern blot analyse gaven één exemplaar van het SS-gen in het algen genoom aan (Okada et al., 2000). Al deze resultaten suggereren dat hetzij gecoördineerde expressie van afzonderlijke synthase genen voor squaleen en botryococcenes bestaan of dat er fysiologische omstandigheden zijn controlerend de squaleen synthase vs. botryococcene synthase activiteit van een enkele polypeptide soort.
XI. Slotopmerkingen
In het licht van het onderzochte materiaal, B. braunii is een potentieel goede vernieuwbare bron van nuttige koolwaterstoffen, polysacchariden en andere speciale chemicaliën. Katalytisch gekraakte algen-koolwaterstoffen hebben voldoende hoge octaangetallen voor gebruik als motorbrandstof. Het gebruik van algen-koolwaterstoffen kan de milieueffecten in verband met het gebruik van steenkool en aardolie sterk verminderen. Ook kan B. braunii worden gebruikt voor het verwijderen van lage niveaus van verontreinigende nitraten en fosfaten uit afvalwater.
Op dit moment is de productie van fotosynthetische stookolie niet concurrerend met aardolie-afgeleide brandstoffen. Een reden hiervoor is een relatief trage groei van B. braunii. De koolwaterstof-synthese genen van B. braunii zijn gekloond in andere micro-organismen. Dit kan mogelijk de productiesnelheid verhogen en problemen die samenhangen met een hoge viscositeit van B. braunii bouillons verminderen. Aanzienlijke ontwikkelingsinspanning is nodig om consistent B. braunii in grootschalige systemen te kweken.
Referenties
Acién Fernández, F. G., Fernández Sevilla, J. M., Sánchez Pérez, J. A., Molina Grima, E., and Chisti, Y. 2001. Airlift-driven external-loop tubular photobioreactors for outdoor production of microalgae: assessment of design and performance. Chem. Eng. Sci. 56: 2721.
Allard, B. and Casadevall, E. 1990. Carbohydrate composition and characterisation of sugars from the green microalga Botryococcus braunii. Phytochem. 29: 1875.
Anderson, D. B. and Eakin, D. E. 1985. A process for the production of polysaccharides from microalgae. Biotechnol. Bioeng. Symp. 15: 533.
Bailliez, C., Largeau, C., and Casadevall, E. 1985. Growth and hydrocarbon production of Botryococcus braunii immobilized in calcium alginate gel. Appl. Microbiol. Biotechnol. 23: 99.
Bailliez, C., Largeau, C., Berkaloff, C., and Casadevall, E. 1986. Immobilization of Botryococcus braunii in alginate, influence on chlorophyll content, photosynthetic activity and degeneration during batch culture. Appl. Microbiol. Biotechnol. 23: 361.
Bailliez, C., Largeau, C., Casadevall, E., Yang, L. W., and Berkaloff, C. 1988. Photosynthesis, growth and hydrocarbon production of Botryococcus braunii immobilized by entrapment and adsorption in polyurethane foams. Appl. Microbiol. Biotechnol. 29: 141.
Behrens, A., Schaeffer, P., Bernasconi, S., and Alrecht, P. 2000. 7,11-cyclobotryococca 5,12,26-triene, a novel botryococcene related hydrocarbon occurring in environment. Organic Lett. 2: 1271.
Belarbi, E. H., Molina, E., and Chisti, Y. 2000. A process for high yield and scaleable recovery of high purity eicosapentaenoic acid esters from microalgae and fish oil. Enzyme Microb. Technol. 26: 516.
Ben-Amotz, A., Torbene, T. G., and Thomas, W. H. 1985. Chemical profile of selected species of microalgae with emphasis on lipids. J. Phycol. 21: 72.
Bertheas, O., Metzger, P., and Largeau, C. 1999. A high molecular weight complex lipid, aliphatic polyaldehyde tetraterpeen diol polyacetal from race L of Botryococcus braunii. Phytochemistry 50: 85.
Blackburn, K. B. 1936. Botryococcus and algal coal. Trans. R. Soc. Edin. 58: 841.
Brenckman, F., Largeau, C., Casadevall, E., and Berkaloff, C. 1989. Effect of nitrogen nutrition on growth and hydrocarbon production of the unicellular microalga Botryococcus braunii. Comm. Eur. Communities, Energy Biomass 717.
Brown, A. G. and Knights, B. A. 1969. Hydrocarbon content and it’s relationship to physiological state in the green alga Botryococcus braunii. Phytochemistry 8: 543.
Cane, R. F. 1977. Coorongite, balkashite and related substances—an annotated bibliography. Trans. R. Soc. S. Aust. 101: 153.
Casadevall, E., Largeau, C., Metzger, P., Chirac, C., Berkaloff, C., and Coute, A. 1983. Hydrocarbon production by unicellular microalga Botryococcus braunii. Biosciences 2: 129.
Casadevall, E., Dif, D., Largeau, C., Gudin, C., Chamount, D., and Desanti, O. 1985. Studies on batch and continuous culture of Botryococcus braunii: hydrocarbon production in relation to physiological state, cell ultrastructure and phosphate nutrition. Biotechnol. Bioeng. 27: 286.
Chirac, C., Casadevall, E., Largeau, C., and Metzger, P. 1985. Bacterial influence upon growth and hydrocarbon production of the alga Botryococcus braunii. J. Phycol. 21: 380.
Chisti, Y. 1980. An unusual hydrocarbon. J. Ramsay Society 27-28: 24-26.
Chisti, Y. 1989. Airlift Bioreactors, Elsevier, London.
Chisti, Y. 1998. Strategies in downstream processing. In Bioseparation and Bioprocessing: A Handbook, vol. 2, Subramanian, G., Ed., Wiley-VCH, New York, 3.
Chisti, Y. 1999. Shear sensitivity. In: Encyclopedia of Bioprocess Technology: Fermentation, Biocatalysis, and Bioseparation, vol. 5, Flickinger, M. C. and Drew, S. W., Eds., Wiley, New York, 2379.
David, M., Metzger, P., and Casadevall, E. 1988. Two cyclobotryococcenes from the B race of green alga Botryococcus braunii. Phytochemistry 27: 2863.
Dennis, M. W. and Kolattukudy, P. E. 1991. Alkane biosynthesis by decarbonylation of aldehyde catalyzed by a microsomal preparation from Botryococcus braunii. Arch. Biochem. Biophys. 287: 268.
Derenne, S., Largeau, C., Casadevall, E., and Connan, J. 1988. Mechanism of formation and chemical structure of coorongite. Structure and origin of the labile fraction. Fate of botryococcenes during early diagenesis. Org. Geochem. 13: 965.
Dernne, S., Largeau, C., Casadevall, E., and Berkaloff, C. 1989. Comparative study of rat and tobacco squalene. Phytochemistry 38: 1137.
Dote, Y., Sawayama, S., and Yokoyama, S. 1992. Liquefaction of hydrocarbon-rich microalga. Am. Chem. Soc. Div. Fuel Chem. 37: 1836.
Fallon, R. D. and Brock, T. D. 1979. Decomposition of blue green algal (cyanobacterial) blooms in lake Mendota, Wisconsin. Appl. Environ. Microbiol. 37: 820.
Fernandes, H. L., Tomme, M. M., Lupi, F. M., Fialho, A. M., Sa Correia, I., and Novais, J. M. 1989. Biosynthesis of high concentration of an exopolysaccharide during cultivation of the microalga Botryococcus braunii. Biotechnol. Lett. 11: 433.
Frenz, J., Largeau, C., and Casadevall, E. 1989a. Hydrocarbon recovery by extraction with a biocompatible solvent from free and immobilized cultures of Botryococcus braunii. Enzyme Microb. Technol. 11: 717.
Frenz, Z., Largeau, C., Csadevall, C., Kollerup, F., and Daugulis, A. J. 1989b. Hydrocarbon recovery and biocompatibility of solvents for extraction from cultures of Botryococcus braunii. Biotechnol. Bioeng. 34: 755.
Gelpi, E., Schneider, H., Mann, J., and Oro, J. 1970. Hydrocarbons of geochemical significance in microscopic algae. Phytochemistry 9: 603.
Goodway, G. W., Fawcett, P., Green, D., and Shaw, G. 1973. Sporopollenin formation in the ascospore wall of Neurospora crassa. Arch. Microbiol. 101: 145.
Grung, M., Metzger, P., and Liaaen-Jensen, S. 1989. Algal carotenoids, primary and secondary carotenoids in two races of green alga Botryococcus braunii. Biochem. Sys. Eco. 17: 263.
Grung, M., Metzger, P., and Liaaen-Jensen, S. 1994. Secondary carotenoids in Botryococcus braunii race L, new strain. Biochem. Sys. Eco. 22: 25.
Gu, P., Ishii, Y., Spencer, T. A., and Shechter, I. 1998. Function-structure studies and identification of three enzyme domain involved in the catalytic activity in rat hepatic squalene synthase. J. Biol. Chem. 273: 12515
Gudin, C. and Thomas, D. 1981. Production de polysaccharides sulfates par un biophotoreacteur a cellules immobilisees de Porphyridium curentum. C. R. Sci. Paris 293: 35.
Gudin, C., Bernard, A., Chaumont, D. T., Thepnier, C., and Hardy, T. 1984. Direct conversion of solar energy into organic chemicals. World Biotech. Rep. 1: 541.
Guzman-Murillo, M. A. and Ascencio, F. 2000. Anti adhesive activity of sulfated polysaccharides of microalgae on attachment of red sore diseaseassociated bacteria and Helicobacter pylori to tissue culture cells. Lett. Appl. Microbiol. 30: 473.
Haines, K. C. and Guillard, R. R. L. 1974. Growth of vitamin B12 requiring marine diatoms in mixed laboratory cultures with vitamin B12 producing marine bacteria. J. Phycol. 10: 245.
Held, W., Peters, M., Buhs, C., Oelert, H. H., Reifenstahl, G., and Wagner, F. 1985. Production of hydrocarbon from biomass. Comm. Eur. Communities, Energy Biomass 744.
Huang, Z., Poulter, C. D., Wolf, F. R., Somers, T. C., and White, J. D. 1988. Braunicene, a novel cyclic C32 isoprenoid from Botryococcus braunii. J. Am. Chem. Soc. 110: 3959.
Huang, J. and Poulter, C. D. 1989. Tetramethyl squalene, a triterpene from Botryococcus braunii var showa. Phytochem. 28: 1467.
Inone, H., Korenaga, T., Sagami, H., Koyama, T., Sugiyama, H., and Ogura, K. 1993. Formation of farnesal and 3-hydroxy-2,3-dihydrofarnesal from farnesol by protoplasts of Botryococcus braunii. Biochem. Biophys. Res. Commun. 196: 1401.
Inone, H., Korenaga, T., Sagami, H., and Ogura, K. 1994a. Phosphorylation of farnesol by a cell free system of Botryococcus braunii. Biochem. Biophys. Res. Commun. 200: 1036.
Inoue, S., Dote, Y., Sawayama, S., Minowa, T., Ogi, T., and Yokoyama, S. 1994b. Analysis of oil derived from liquefaction of Botryococcus braunii. Biomass Bioenergy 6: 269.
Jarstfer, M. B., Blagg, B. S. J., Rogers, D. H., and Poulter, C. D. 1996. Biosynthesis of squalene. Evidence for a tertiary cyclopropylcarbinyl cationic intermediate in the rearrangement of presqualene diphosphateto squalene. J. Am. Chem. Soc. 118: 13089.
Jones, J. G. 1972. Studies on freshwater bacteria: association with algae and alkaline phosphatase activity. J. Ecol. 60: 59.
Kitazato, H., Asaoka, S., and Iwamoto, H. 1989. Catalytic cracking of hydrocarbons from microalgae. Sekiyu Gakkaishi 32: 28.
Kojima, E. and Zhang, K. 1999. Growth and hydrocarbon production by microalga Botryococcus braunii in bubble column photobioreactor. J. Bioscience Bioeng. 87: 811.
Koren, K. M. and Rayburn, W. R. 1984. Influence of growth status and nutrients on exocellular polysaccharides synthesis by the soil alga Chlamydomonas mexicana. J. Phycol. 20: 253.
Lareillard, J., Largeau, C., and Casadevall, E. 1988. Oleic acid in the biosynthesis of resistant polymer of Botryococcus braunii. Phytochemistry 27: 2095.
Largeau, C., Casadevall, E., Berkaloff, C., and Dhamliencourt, P. 1980. Sites of accumulation and composition of hydrocarbons in Botryococcus braunii. Phytochemistry 19: 1043.
Lee, S. J., Kim, S. B., Kim, H. S., Kwon, G. S., Yoon, B. D., and Oh, H. M. 1999. Mass cultivation of Botryococcus braunii for advanced treatment of swine waste water and lipid production in photobioreactor. Sanop Misaengmul Hakhoechi 27: 166.
Lichitfouse, E., Derenne, S., Mariotti, A., and Largeau, C. 1994. Possible algal origin of long chain odd n-alkanes in immature sediments as revealed by distribution and carbon isotope ratios. Org. Geochem. 22: 1023.
Lupi, F. M., Fernandes, H. M. L., Sa Correia, I., and Novais, J. M. 1991. Temperature profiles of cellular growth exopolysaccharide synthesis by Botryococcus braunii. J. Phycol. 3: 35.
Lupi, F. M., Fernandes, H. M. L., Tomme, M. M., Sa Correia, I., and Novais, J. M. 1994. Influence of nitrogen source and photoperiod on exopolysaccharide synthesis by the microalga Botryococcus braunii. Enzyme Microb. Technol. 16: 546.
Mcirdy, D. M., Cox, R. E., Vlkman, J. K., and Howel, V. J. 1986. Botryococcane in a new class of Australian non marine crude oils. Nature 320: 57.
Mendes, R. L., Coelho, J. P., and Fernandes, H. L. 1995. Application of supercritical CO2 extraction to microalgae and plants. J. Chem. Technol. Biotechnol. 62: 53.
Metzger, P., Berkaloff, C., Casadevall, E., and Coute, A. 1985a. Alkadiene and botryococcene producing races of wild strains of Botryococcus braunii. Phytochem. 24: 2305.
Metzger, P., Casadevall, E., Pouet, M. J., and Pouet, Y. 1985b. Structure of some botryococcenes: branched hydrocarbons from the B race of the green alga Botryococcus braunii. Phytochem. 24: 2995.
Metzger, P. and Casadevall, E. 1987. Lycopadiene, a tetraterpenoid hydrocarbon from new strains of the green alga Botryococcus braunii. Tetrahedron Lett. 24: 2305.
Metzger, P., David, M., and Casadevall, E. 1987. Biosynthesis of triterpenoid hydrocarbons in the B race of green alga Botryococcus braunii. Sites of production and nature of methylating agent. Phytochem. 26: 129.
Metzger, P., Casadevall, E., and Coute, A. 1988. Botryococcene distribution in strains of green alga Botryococcus braunii. Phytochemistry 27: 1383.
Metzger, P. and Casadevall, E. 1989. Aldehydes, very long chain alkenyl phenols, epoxides and other lipids from an alkadiene producing strain of Botryococcus braunii. Phytochemistry 28: 2097.
Metzger, P., Allard, B., Casadevall, E., Berkaloff, C., and Coute, A. 1990. Structure and chemistry of a new chemical race of Botryococcus braunii (chlorophyceae) that produces lycopadiene, a tetraterpenoid hydrocarbon. J. Phycol. 26: 258.
Metzger, P. and Casadevall, E. 1991. Botryococcoid ethers, ether lipids from Botryococcus braunii. Phytochemistry 30: 1439.
Metzger, P., Villarreal-Rosales, E., and Casadevall, E. 1991. Methyl branched fatty aldehydes and fatty acids in Botryococcus braunii. Phytochemistry 30: 185.
Metzger, P. and Casadevall, E. 1992. Ether lipids from Botryococcus braunii and their biosynthesis. Phytochemistry 31: 2341.
Metzger, P. and Pouet, Y. 1995. n-Alkyl pyrogallol dimethyl ethers, aliphatic diol monoesters and some minor ether lipids from Botryococcus braunii (A race). Phytochemistry 40: 543.
Metzger, P. and Aumelas, A. 1997. Lycopanerol-A, di-tetraterpenoid tetraether derivatives from green microalga Botryococcus braunii L race. Tetrahedron Lett. 38: 2977.
Mirón, A. S., Gómez, A. C., Camacho, F. G., Grima, E. M., and Chisti, Y. 1999. Comparative evaluation of compact photobioreactors for large-scale monoculture of microalgae. J. Biotechnol. 70: 249.
Mirón, A. S., Camacho, F. G., Gómez, A. C., Grima, E. M., and Chisti, Y. 2000. Bubble column and airlift photobioreactors for algal culture. AIChE J. 46: 1872.
Moldwan, J. M. and Seifert, W. K. 1980. First discovery of botryococcane in petroleum. J. C. S. Chem. Commun. 1: 912.
Molina, E., Fernández, F. G. A., Camacho, F. G., and Chisti, Y. 1999. Photobioreactors: light regime, mass transfer, and scaleup. J. Biotechnol. 70: 231.
Molina, E., Acién Fernández, F. G., García Camacho, F., Camacho Rubio, F., and Chisti, Y. 2000. Scale-up of tubular photobioreactors. J. Appl. Phycol. 12: 355.
Molina, E., Fernández, J., Acién, F. G., and Chisti, Y., 2001. Tubular photobioreactor design for algal cultures. J. Biotechnol. 92: 113.
Murakami, M., Nakano, H., Yamaguchi, K., Konosu, S., Nakayama, O., Matsumoto, Y., and Iwamoto, H. 1988. Meijicoccene, a new cyclic hydrocarbon from Botryococcus braunii. Phytochemistry 27: 455.
Murakami, N. 2000. Plant growth regulator composition and their manufacture. Jpn. Kokai Tokkyo Koho 264: 809.
Murry, J. and Thomson, A. 1977. Hydrocarbon production in Anacystis montana and Botryococcus braunii. Phytochemistry 16: 465.
Oh, H. M., Kim, S., Park, E. R., Lee, S. T., Kwon, J. S., and Yoon, B. D. 1997. Effects of light intensity and nutrients on the growth of Botryococcus sp. Misaengmul Hakhoechi 25: 339.
Ohmori, M., Wolf, F. R., and Bassham, J. A. 1984. Botryococcus braunii carbon/nitrogen metabolism as affected by ammonia addition. Arch. Microbiol. 140: 101.
Okada, S., Mastuda, M., and Yamaguchi, K. 1996. Botryoxanthin-A a new member of the new class of carotenoids from green microalga Botryococcus braunii, Berkeley. Tetrahedron Lett. 37: 1065.
Okada, S., Tonegawa, I., Mastuda, H., Murakami, M., and Yamaguchi, K. 1997. Carotenoids from green microalga Botryococcus braunii. Tetrahedron 53: 11307.
Okada, S., Tonegawa, I., Mastuda, H., Murakami, M., and Yamaguchi, K. 1998. Botryoxanthin-B and alpha botryoxanthin-A from green microalga Botryococcus braunii. Phytochemistry 47: 1111.
Okada, S., Devarenne, T. P., and Chappel, J. 2000. Molecular characterization of squalene synthase from the green alga Botryococcus braunii, race B. Arch. Biochem. Biophys. 373: 307.
Parker, B. C. and Bold, H. C. 1961. Biotic relationships between soil algae and other microorganisms. Am. J. Botany 48: 185.
Poulter, C. D. and Hughes, J. M. 1977. Model studies of the biosynthesis of non-head to tail terpenes. Stereochemistry of ionization for N-methyl-4[(1S, 1’R, 3’R)-[1-2H] chrysanthemyloxy]pyridinium iodide. J. Am. Chem. Soc. 99: 3824.
Poulter, C. D., Marsh, L., Argyle, J. C., Dennis, M. S., Robyn, J. G., and Scott, G. M. 1977. Model studies of biosynthesis of non-head to tail terpenes. Rearrangements of the chrysanthemyl system. J. Am. Chem. Soc. 99: 3816.
Rager, M. N. and Metzger, P. 2000. Six novel tetraterpenoid ethers, lycopanerols B-G, and some other constituents from green microalga Botryococcus braunii. Phytochemistry 54: 427.
Reim, R. L., Shane, M. S., and Cannon, R. E. 1974. The characterization of a Bacillus capable of blue green bactericidal activity. Can. J. Microbiol. 20: 981.
Robinson, G. Y., Tsay, Y. H., Kienzle, B. K., Smith-Monroy, C. A., and Bishop, R. W. 1993. Conservation between human and fungal squalene synthases: similarities in structure, function and regulation. Mol. Cell Biol. 13: 2706.
Saks, N. M. and Kahn, E. G. 1979. Substrate competition between a salt marsh diatom and a bacterial population. J. Phycol. 15: 17.
Sawayama, S., Minowa, T., Dote, Y., and Yokoyama, S. 1992. Growth of the hydrocarbon rich microalga Botryococcus braunii in secondarily treated sewage. Appl. Microbiol. Biotechnol. 38: 135.
Sawayama, S., Inone, S., and Tokoyama, S. 1994. Continuous culture of hydrocarbon rich microalga Botryococcus braunii secondarily treated sewage. Appl. Microbiol. Biotechnol. 41: 729.
Sawayama, S., Inoue, S., and Yokoyama, S. 1995. Phylogenetic position of Botryococcus braunii based on small subunit of ribosomal RNA sequence data. J. Phycol. 31: 419.
Sawayama, S., Minowa, T., and Yokoyama, S. 1999. Possibility of renewable energy production and carbon dioxide mitigation by thermochemical liquefaction of microalgae. Biomass Bioenergy 17: 33.
Swale, E. M. F. 1968. The phytoplankton of Oakmere, Cheshire. Br. Phycol. Bull. 3: 441.
Templier, J., Largeau, C., and Casadevall, E. 1984. Hydrocarbon formation in the green alga Botryococcus braunii and mechanism of nonisoprenoid hydrocarbon biosynthesis. Phytochem. 23: 1017.
Templier, J., Largeau, C., and Casadevall, E. 1991a. Biosynthesis of n-alkatrienes in Botryococcus braunii. Phytochemistry 30: 2209.
Templier, J., Largeau, C., and Casadevall, E. 1991b. Non-specific elongation-decarboxylation in biosynthesis of cis and trans-alkadienes by Botryococcus braunii. Phytochemistry 30: 175.
Templier, J., Disendorf, C., Largeau, C., and Casadevall, E. 1992a. Metabolism of n-alkadienes in the A race of Botryococcus braunii. Phytochemistry 31: 113.
Templier, J., Largeau, C., and Casadevall, E. 1992b. Chemical inhibition of resistant biopolymers in the outer walls of A and B races of Botryococcus braunii. Phytochemistry 31: 4097.
Templier, J., Largeau, C., and Casadevall, E. 1993. Variation in external and internal lipid associated with inhibition of resistant biopolymer from the A race of Botryococcus braunii. Phytochemistry 33: 1079.
Tonegawa, I., Okada, S., Murakami, M., and Yamaguchi, K. 1998. Pigment composition of the green microalga Botryococcus braunii, Kawaguchi. Fish Sc. 64: 305.
Vanquez, R. and Bertha, O. 1991. Haloadaption of the green alga Botryococcus braunii. Phytochemistry 30: 2919.
Volova, T. G., Kalacheva, G. S., Zhilo, N. O., and Plotnicov, V. F. 1998. Physiological and biochemical properties of the alga Botryococcus braunii. Russ. J. Plant. Physol. 45: 725.
Wake, L. V. and Hillen, L. W. 1981. Nature and hydrocarbon content of the blooms of the alga Botryococcus braunii occurring in Australian fresh water lakes. Aust. J. Mar. Freshwater Res. 32: 353.
Wang, X. and Kolattukudy, P. E. 1995. Solubilization and purification of aldehyde generating fatty acyl-CoA reductase from green alga Botryococcus braunii. FEBS Lett. 370: 15.
Wang, X. and Xie, S. 1996. Effects of several factors on growth of Botryococcus braunii. Weishengwuxue Tongbao 23: 275.
Weetal, H. H. 1985. Studies on nutritional requirements of the oil producing alga Botryococcus braunii. Appl. Biochem. Biotechnol. 11: 377.
Weissman, J. C., Goebel, R. P., and Benemann, J. R. 1988. Photobioreactor design: mixing, carbon utilization, and oxygen accumulation. Biotechnol. Bioeng. 31: 336.
Wolf, F. R., Nanomura, A. M., and Bassham, J. A. 1985a. Growth and branched hydrocarbon production in a strain of Botryococcus braunii. J. Phycol. 21: 388.
Wolf, F. R., Nemethy, E. K., Blanding, J. H., and Bassham, J. A. 1985b. Biosynthesis of unusual acyclic isoprenoids in the green alga Botryococcus braunii. Phytochemistry 24: 733.
Yang, L. W. and Wang, X. Y. 1989. Studies on hydrocarbon production by immobilized Botryococcus braunii cells. Rev. Roum. Chim. 34: 397.
Yong, T. P. C., Largeau, C., and Casadevall, E. 1986. Biosynthesis of non-isoprenoid hydrocarbons by the microalga Botryococcus braunii. Evidences for elongation- decarboxylation mechanism. Nouv. J. Chim. 10: 701.
Zhang, D. and Poulter, C. D. 1995. Biosynthesis of non head to tail isoprenoid. Synthesis of 1'-1 and 1'-3 structures by recombinant yeast squalene synthase. J. Am. Chem. Soc. 117: 1641.
Zhang, K. and Kojima, E. 1998. Effect of light intensity on colony size of microalga Botryococcus braunii in bubble column photobioreactor. J. Fermentation Bioeng. 86: 573.